
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2. По полярности
В зависимости от полярности поверхности различают полярные и неполярные адсорбенты.
Полярные адсорбенты содержат на своей поверхности полярные группы, такие как –ОН, -СООН, -SO3OHи т.д. Примерами могут служить силикагель, оксид алюминия, аэрогель и т.п. Неполярные адсорбенты не содержат полярных групп. Это - сажа, активированный уголь, никель Ренея и т.п. Следует отметить, что путём модифицирования можно изменить свойств поверхности. Так, частичным окислением поверхности получают полярные сажи.
полярные — бумага, силикагель, алюмогель
неполярные — сажа, угли
3. По размеру пор
В зависимости от преобладания пор того или иного размера(среднего радиуса пор) адсорбенты классифицируют на:
макропористые – в них преобладают макропоры с диаметрами 100 – 200 нм. Примером может служить технический углерод;
мезопористые– в них преобладают мезопоры с диаметрами 2 - 100 нм. Это - шариковый оксид алюминия, алюмосиликаты и т.п.;
микропористые– в них преобладают микропоры с диаметром < 5 нм – активированный уголь, бемитный гидроксид алюминия, силикагели и т.п.
В большинстве перечисленных систем имеется бипористая структура: первичные микропоры внутри частиц (глобул) и вторичные мезо- и макропоры, образуемые пространством между частицами.
Пористость (П) определяется по формуле (2.99): П = Vпор/Vадсорбента
Макропоры переходнопористые микропористые
d = 100 — 200 нм 2 — 100 нм 0,5 — 1,5-2,0 нм
Sуд = 0,2—2 м2/г 10 — 500 м2/г 500 — 1000 м2/г
2.4.5.2. Влияние кривизны поверхности на равновесие фаз
До сих пор мы рассматривали поверхностные явления в системах, в которых сосуществующие фазы разделены плоской межфазной границей (с большим радиусом кривизны — см. ниже). Искривление поверхности раздела фаз вносит изменения в термодинамические свойства системы и обусловливает некоторые важные эффекты, относящиеся к числу капиллярных явлений.
Давления в контактирующих фазах, разделенных плоской поверхностью в условиях равновесия одинаковы. В отличие от этого давления в фазах, разделенных искривленной поверхностью, например, сферической, отличаются.
Пример. В этом легко убедиться на примере образования мыльных пузырей: если оставить в трубочке открытым отверстие, то под действием большего давления в пузырьке воздух начнет выходить, а размеры пузырька уменьшатся вплоть до его исчезновения. При этом уменьшаются поверхность пузырька и связанная с ней поверхностная энергия.
Что избыточное давление возрастает с уменьшением радиуса пузырька (радиуса кривизны — см. далее) можно доказать, выдув два пузырька разных размеров, а затем их соединив: маленький пузырек будет уменьшаться, а большой увеличиваться вплоть до полного перехода воздуха из малого в большой.
Вспомним, что из-за избыточной поверхностной энергии жидкая фаза благодаря своей подвижности приобретает сферическую форму в условиях невесомости. Вода в реках, морях, озёрах имеет плоскую поверхность только потому, что действует сила тяжести (F). С уменьшением количества жидкости её роль снижается, т.к. F ~ d3 (V), а S ~ d2 ; Sуд=↑. Возрастающая роль поверхностной энергии проявляется в появлении кривизны поверхности жидкой фазы.
Рассмотрим изменение давления насыщенного пара жидкостипри искривлении её поверхности (насыщенным называют пар, находящийся в равновесии со своей жидкостью) в трёх случаях: поверхность жидкости плоская, поверхность жидкости вогнутая и поверхность жидкости выпуклая (рис.2.29)
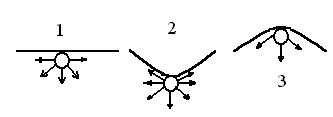
Рис.2.29. Межмолекулярные взаимодействия на искривлённой поверхности жидкости
Наиболее интенсивные взаимодействия в поверхностном слое жидкости наблюдаются в случае вогнутой поверхности (2). Здесь любая поверхностная молекула окружена максимальным числом «соседей». Выход её в газовую фазу в данном случае потребует наибольших затрат энергии. Поэтому следует ожидать, что над вогнутой поверхностью давление насыщенного пара будет минимальным.
В случае выпуклой поверхности жидкости (3) число молекул, окружающих выделенную поверхностную молекулу, минимально и, соответственно, давление насыщенного пара будет максимальным.Среднее положение занимает плоская поверхность.
Таким образом, давление насыщенного пара зависит от кривизны поверхности жидкости: над выпуклой поверхностью оно больше, а над вогнутой оно меньше, чем над плоской. И чем больше кривизна поверхности, тем сильнее отличаются друг от друга давления над плоской и искривленной поверхностью.
Рассмотрим результат влияния кривизны поверхности раздела между 2 несмешивающимися жидкостями на внутреннее давление Р в контактирующих фазах.
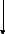


![]()





 ΔР
ΔР
![]()
 r
r![]()
Рис. 2.30. Влияние кривизны поверхности раздела на внутреннее давление
Кривизна
поверхности
![]() вызывает изменение площади и положения
межфазной поверхности, что можно выразить
изменением поверхностной энергии (σ
dS),
изменяются объёмы фаз 1 и 2:
dV1=
-dV2,
что ведет
к изменению энергий ΔЕ
фаз 1 и 2 на ΔЕ1=
р1dV1
и
ΔЕ2=р2dV2
(р1
и
р2
—
внутренние давления внутри фаз).
вызывает изменение площади и положения
межфазной поверхности, что можно выразить
изменением поверхностной энергии (σ
dS),
изменяются объёмы фаз 1 и 2:
dV1=
-dV2,
что ведет
к изменению энергий ΔЕ
фаз 1 и 2 на ΔЕ1=
р1dV1
и
ΔЕ2=р2dV2
(р1
и
р2
—
внутренние давления внутри фаз).
Соотношение между поверхностной энергий и «объёмной» можно записать с помощью обобщенного уравнения 1 и 2-го законов термодинамики относительно энергии Гельмгольца F при Т=const:
dF=- р1dV1 - р2dV2 + σ dS (2.100)
При равновесии фаз ΔF=0, тогда
(р1
-
р2)
dV2+
σ dS
= 0, ΔР=
р2
-
р1=
σ![]() (2.101)
(2.101)
![]() — кривизна поверхности. Чем больше
поверхностное натяжение, тем выше
влияние кривизны поверхности. Вывод из
уравнения следующий:
— кривизна поверхности. Чем больше
поверхностное натяжение, тем выше
влияние кривизны поверхности. Вывод из
уравнения следующий:
Фазы, разделённые искривлённой поверхностью, могут находиться в равновесии только при разных давлениях Р внутри фаз.
В фазе, имеющей «+» кривизну давление выше, чем в фазе с «—» кривизной. Стремление межфазного поверхностного натяжения сократить поверхность ведет к увеличению давления во второй фазе. Эту разность ΔРможно представить как равнодействующую силσ, сходящихся в т.О.ΔРнаправлена перпендикулярно к поверхности в центр кривизны.
ΔР = Рσ — разность давлений в соседних фазах, разделённых искривленной поверхностью, называетсякапиллярным давлением.
Если Р1=const(напр. атмосферное), тоΔР — изменение давлений в конденсированной фазе с кривизной (Рr) по сравнению с давлением в такой же фазе под ровной поверхностью (Р∞) равно :ΔР= Рr- Р∞.
Рассчитаем его для разных поверхностей:
Для
сферической поверхности![]() ==
==![]() 2/r: (8πr
dr/4πr2
dr) (2.102)
2/r: (8πr
dr/4πr2
dr) (2.102)
ΔР=![]() 2σ/r — (2.103)
2σ/r — (2.103)
- уравнение Лапласа(*), рассчитывающее избыточное лапласовское давление.Чем меньше радиус, тем больше капиллярное давление.
Для капли воды с r=10-6 м ΔР=15 МПа (1,5 атм)— это немного — доля его во внутреннем давлении (приблизительно 1000 МПа) =0,1%, но достаточна для образования сферы. Такое жеΔРхарактерно и для пузырьков воздуха в жидкости. Для каплиr=10-9 м ΔР уже составляет = 10%.
Цилиндрическая поверхностьдлинойlи радиусомrимеет кривизну, равную
![]() ==
==![]() 1/r ΔР=
1/r ΔР=
![]() σ/r
(2.104)
σ/r
(2.104)
Для поверхности неправильной формы используется представление о средней кривизне поверхности по уравнению Н=1/2(1/r1+1/r2), где r1 и r2 — кривизна главных нормальных сечений.
ΔРнаправлено всегда в центр кривизны. Если он находится вне жидкости, то кривизна отрицательная «—», (внутреннее давление жидкости уменьшается, жидкость растягивается), а если в жидкости, то положительная «+» (внутреннее давление жидкости увеличивается, жидкость сжимается).
Избыточное давление лежит в основе метода по расчету поверхностных натяжений жидкости — метод максимального давления в пузырькепо формуле:σ=к ΔР, к — константа прибора.
П












 узырек
воздуха, растущий на конце капилляра
под действием разности давлений между
атмосферой и прибором, образует полусферу.
В момент, когда капиллярное давление
не может уравновесить приложенной
разности давленийΔР,
пузырек отрывается:ΔР>2σ/rо,
где rо— радиус капилляра. Максимальное
давление соответствует образованию
полусферы пузырька воздуха радиусом,
равным радиусу капилляра, и его отрыву
от кольца.
узырек
воздуха, растущий на конце капилляра
под действием разности давлений между
атмосферой и прибором, образует полусферу.
В момент, когда капиллярное давление
не может уравновесить приложенной
разности давленийΔР,
пузырек отрывается:ΔР>2σ/rо,
где rо— радиус капилляра. Максимальное
давление соответствует образованию
полусферы пузырька воздуха радиусом,
равным радиусу капилляра, и его отрыву
от кольца.
