
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2.4.5.3. Капиллярные явления
Наблюдаются в содержащих жидкость узких сосудах (капилляры, капиллярно-пористые тела), у которых расстояние между стенками капилляра соизмеримо с радиусом кривизны поверхности жидкости
Кривизна возникает в результате взаимодействия жидкости со стенками сосуда адгезия, смачивание). Специфика поведения жидкости зависит от того, смачивает или не смачивает она стенки сосуда.
Рассмотрим положение уровней жидкости в двух капиллярах, один из которых имеет лиофильную поверхность (а), другой — лиофобную (б).




 а б
а б



 h1>0
h1>0
























 h2<0
h2<0
Рис. 2.31. Положение уровней жидкости в капиллярах
а - поверхность жидкой фазы имеет «—» кривизну, ∆р стремится растянуть жидкость и поднимает ее в капилляре до тех пор, пока капиллярное давление не уравновесится с гидростатическим давлением столба жидкости.
б - кривизна в этом случае «+»,∆р направлена внутрь фазы, жидкость опускается.
При равновесии: ∆р=2σ/r = (ρ — ρо) gh (2.105)
Чтобы высоту капиллярного поднятия связать с характеристикой смачивания поверхности, радиус мениска rвыражают через угол смачивания θ и радиус капилляраrо:rо= rcosθ/ (2.106)





 r
r
rо θ
Высота капиллярного поднятия описывается формулой Жюрена(*), которая лежит в основе наиболее точного метода определения поверхностного натяжения. Чем лучше смачивает жидкость стенки капилляра (уголθ→0), тем больше высота поднятия жидкости:
![]()
![]()
Капиллярным поднятием жидкости объясняется ряд известных явлений: пропитка бумаги, тканей, водонепроницамость тканей обеспечивается гидрофобностью — отрицательным поднятием, подъем воды из почвы по стволам растений из-за волокнистого строения древесины, процессы кровообращения в кровеносных сосудах.
По тонким капиллярам жидкость способна подниматься на огромную высоту. Так, в капиллярах радиусом 0,1 мкм вода способна достичь отметки 150 м.
Капиллярное поднятие грунтовых вод в почвах даёт жизнь растительности нашей планеты Земля. Многие агротехнические работы (боронование, пахота и т.п.) ставят одной из своих целей разрушение почвенных капилляров и тем самым предотвращение потери почвой влаги.
2.4.5.4.Теория капиллярной конденсации
Явление капиллярной конденсации состоит в том, что в тонких капиллярах конденсация пара происходит при меньших давлениях,чемдавление насыщенного паранад ровной поверхностьюпри данной температуре в условиях смачиваемости поверхности пор жидким адсорбатом.
Адсорбционная способность твердых пористых тел зависит как от природы взаимодействующих тел, так и от структуры пористого тела.
Чем меньше размер пор, тем сильнее проявляют себя капиллярные силы.
Условия действия капиллярных сил
смачивание поверхности адсорбента жидкостью, которая появляется в результате конденсации пара адсорбата.
наличие пор с удельной поверхностью 10—500 м2/г (r=2—100 нм), что соответствует переходнопористым адсорбентам (см. классификацию). Радиус поры соответствует радиусу кривизны жидкого адсорбата.
Микропористая структура обеспечивает резкое увеличение адсорбционного потенциала из-за перекрытия поверхностных сил. С увеличением давления газа начинают действовать капиллярные силы. Капиллярная конденсация начинается при определенном заполнении пор адсорбента или при определенном значении давления пара адсорбата.
К этому моменту поверхностная энергия практически скомпенсирована в результате полимолекулярной адсорбции, а микропоры заполнены жидким адсорбатом. С увеличением давления газа конденсация происходит и в более крупных порах, радиус мениска жидкости rв которых находится в соответствии с уравнением капиллярной конденсации Кельвина(38):

![]() , (2.107)
, (2.107)
где pr— давление насыщенного пара над искривленной поверхностью,po— давление газообразного адсорбата над плоской поверхностью,Vm — мольный объем жидкого адсорбата, r— радиус поры,R— универсальная газовая постоянная,T— температура.
Из этого уравнения следует, что при смачивании (при «—» кривизне мениска конденсата) конденсация в порах наступает при давлении, меньшем Po (Р/Po <1).
p










 o
<pо <po
o
<pо <po
Рис.2.32. Давлени насыщенного пара над менисками разной кривизны поверхеости
Чем меньше радиус пор, тем при более низких давлениях она заполняется.
Для адсорбентов с переходными порами характерна изотерма адсорбции с петлей капиллярно-конденсационного гистерезиса:
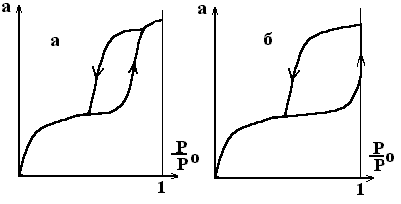
Рис. 2.33. Различные типы петель адсорбционного гистерезиса при капиллярной конденсации.

Начало появления гистерезиса зависит от природы адсорбата и адсорбента. Пористая структура многообразна, но ее можно смоделировать 3 видами пор:
пора конусообразная
А











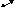
1 р/ро
Конденсация начинается со дна поры, где кривизна наибольшая, по мере заполнения поры радиус увеличивается и давление ротакже возрастает. Процесс десорбции описывается той же кривой.
цилиндрическая пора с открытым концом:
А
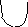

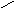
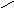










1 р/ро
Конденсация адсорбата идет со дна поры, где кривизна сферическая, т.е. наибольшая. Т.к. пора цилиндрическая, она заполняется при одном значении радиуса мениска, соответствующего определенному давлению Р.(Пора «захлопывается»). Капиллярная конденсация проходит обратимо, т.е. раскрывается при том же давлении, т.к. радиус кривизны не меняется.
цилиндрическая пора с двумя открытыми концами:
А












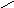


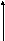


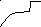


1 р/ро
Наиболее трудный случай. Конденсация начинается на стенках цилиндра, имеющего кривизну в 2 раза меньшую, чем у сферы того же радиуса.
Адсорбция приводит к уменьшению радиуса поры и мгновенному заполнению ее при Р=Рцил. На концах поры образуются сферические мениски, поэтому десорбция идет при давлении, соответствующем большей кривизне — сферической. Отсюда давление открытия поры меньше, чем давление закрытия поры.
Реальный адсорбент имеет поры сложной конфигурации, поэтому на реальной кривой адсорбции можно наблюдать петлю гистерезиса, которая образуется из-за наличия пор с разной кривизной менисков, в том числе и из-за наличия пор с открытыми концами.
Существуют методы, позволяющие по форме кривой адсорбции — десорбции найти размеры и объем пор в данном пористом адсорбенте — ртутная порометрия.
Ртуть не смачивает стенки капилляров практически всех адсорбентов и может проникнуть внутрь них только под действием внешнего давления. Ртуть вдавливают в образец адсорбента, постепенно увеличивая давление. При этом регистрируют зависимость объёма вдавленной ртути от давления. Сначала заполняются ртутью макропоры, затем – мезопоры и, наконец, - микропоры. Путём математической обработки данных порометрии получают дифференциальные кривые, аналогичные изображенным на рис 2.28.
Повтор рис.2.28 – см.2.4.4.
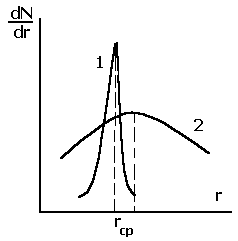
Рис.2.28. Дифференциальные функции распределения пор адсорбента по радиусам: монодисперсное - (1); полидисперсное - (2) распределение пор.
Капиллярная конденсация «ответственна» за намокание при хранении многих пищевых продуктов с развитой поверхностью (мука, быстрорастворимый кофе, сушки и т.д.)
