
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2.4.2.1.Уравнение Ленгмюра(*)
Различают адсорбцию газа на твердом теле, адсорбцию растворенного вещества на границе раствор/газ, адсорбцию растворенного вещества на границе твердое тело/раствор.
Адсорбция газа на твердом теле является простейшим случаем адсорбции, т.к. эта система состоит из двух компонентов. Поэтому адсорбция газа твердым телом удобна для теоретического рассмотрения явления адсорбции.
Имеется несколько теорий физической адсорбции, из которых рассмотрим прежде всего теорию мономолекулярной адсорбции. Эта теория была предложена в 1915 г. американским ученым Ленгмюром, при разработке которой были использованы представления об адсорбционных силах, впервые выдвинутые русским ученым Л.Г.Гурвичем(*). При разработке теории Ленгмюр исходил из следующих положений.
Основные положения теории Ленгмюра:
1. Адсорбция мономолекулярная
2. Адсорбция локализована, т.е. на поверхности адсорбента существуют центры адсорбции
3. Адсорбция идет на энергетически однородной поверхности, т.е. центры адсорбции обладают одинаковой избыточной энергией, и адсорбированные молекулы не взаимодействуют друг с другом
Таким образом, на поверхности адсорбента находятся одинаковые центры адсорбции, каждый из которых может адсорбировать только одну частицу.
Рассмотрим динамическое равновесие между молекулами в газовой фазе и адсорбированными на поверхности как квазихимическую реакцию:
![]()
А – молекулы газовой фазы, В – центры адсорбции на поверхности адсорбента.
При равновесии: vадс = vдес
Vадс= kадс Р (1-Θ), (2.38)
где Θ– доля занятой поверхности![]()
![]() ,
(А∞и Г∞- максимально
возможная адсорбция на всех центрах
адсорбции единицы поверхности).
,
(А∞и Г∞- максимально
возможная адсорбция на всех центрах
адсорбции единицы поверхности).
Vдес= kдес Р Θ (2.39)
При равновесии:
kадс Р (1-Θ) = kдес Р Θ (2.40)
отсюда:
![]() ,
т.е.
,
т.е.
![]() (2.41)
(2.41)
где b– адсорбционный коэффициент, равный отношению констант адсорбции и десорбции.
Уравнения Ленгмюра можно записать в виде:
![]()
![]()
![]() (2.42)
(2.42)
Графически изотерма Ленгмюра представлена на рис.2.15:
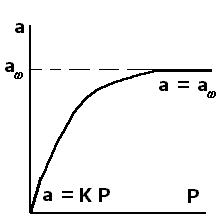
Рис 2.15 Изотерма мономолекулярной адсорбции
При Р→0 уравнение Ленгмюра переходит в уравнение Генри(*):
![]() =КГ Р (2.43)
=КГ Р (2.43)
В этом случае мы имеем линейную зависимость между А и Р, её часто называютизотермой Генри, при этом КГназывают константой Генри, а область малых Р – областью Генри. На рис. 2.15 область Генри представлена прямой линией, выходящей из начала координат.
Если bP>> 1 (область высоких давлений), то уравнение Ленгмюра преобразуется к виду:
А = А (2.44)
В этом случае наблюдается независимость А от Р: при больших Р все центры адсорбции заполнены (на каждой «клетке доски» уже стоит своя «фигура») и дальнейшее увеличение давления не изменяет адсорбции. На рис. 2.15 эта область изображена прямой, параллельной оси абсцисс. Между двумя указанными областями мы имеем кривую – гиперболу.
Наклон кривой определяется константой равновесия b, которая в свою очередь зависит от энергии взаимодействия адсорбата и адсорбента и зависит от температуры: с увеличением температуры b экспоненциально уменьшается.
Покажем это.
Первый вариант:
Уравнение Аррениуса
учитывает влияние температуры на
константу скорости химической реакции:![]()
![]() (2.45)
(2.45)
 lnk
lnk

tgα= -E/RT, гдеα— угол наклона прямой (2.46)

1/T
Так как b– это отношение констант скоростей процессов, то можно записать:
![]() , (2.47)
, (2.47)
т.к. Еактможет быть представлена соотношением: Еакт= ΔН – ТΔS(2.48)
Соотношение констант адсорбции и десорбции с увеличением температуры уменьшается, причем по экспоненте, т.к. ΔНадсвсегда <0. Поэтому адсорбция с увеличением температуры количественно всегда уменьшается.
Или так:
Адсорбционный коэффициент b характеризует способность веществ адсорбироваться на поверхности, т.е. степень его «сродства» к адсорбционным центрам адсорбента. На рис. 2.16.а представлены изотермы адсорбции при различных значениях b3 > b2 > b1. Как и всякая константа равновесия, адсорбционный коэффициент связан с теплотой адсорбцииHaуравнением изотермы Вант-Гоффа(*)(2.47):
![]() .
.
Так как всегда Ha < 0, тос повышением температуры b экспоненциально уменьшается,т.е. и физическая, и химическая адсорбции (величиныА или Г) уменьшаются с повышением температуры (см. изобару адсорбции на рис.2.12).
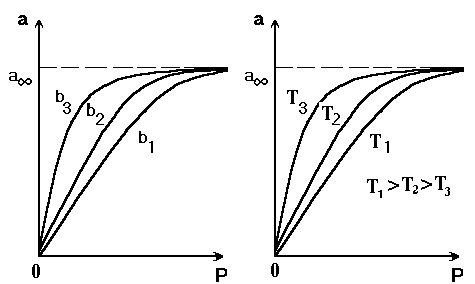
ab
Рис.2.16. Изотермы Ленгмюра при различных значениях константы b: b3>b2>b1 (а), и температуры Т: Т1>T2>T3 (b).
Изостера
адсорбции на рис.2.12 также иллюстрирует
данное положение: при повышении
температуры адсорбция снижается и для
поддержания её постоянного значения
(Аили=const)
следует увеличивать давление. Следует,
однако, помнить, что Аи Гзависят
только от количества адсорбционных
центров и при всех температурах они
одинаковы (рис.2.16.b).![]()
