
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
Устойчивость и стабилизация эмульсий
По мере диспергации эмульсии суммарная поверхность раздела фаз жидкость - жидкость резко возрастает, что приводит к увеличению поверхностной энергии Гиббса SG. Приготовленные без стабилизаторов эмульсии термодинамически и кинетически неустойчивы и быстро коагулируют. Процесс слияния капель дисперсной фазы называют коалесценцией. В отличие от коагуляции, коалесценция необратима.
Коалесценция эмульсий сопровождается непрерывным увеличением диаметра капелек дисперсной фазы, что в итоге приводит к потере системой седиментационной устойчивости и расслаиванию жидкостей. Размеры частиц дисперсной фазы обычно превышают 1 мкм, т.е. в таких эмульсиях не наблюдается броуновского движения, и они изначально седиментационно неустойчивы.
При длительном стоянии подобных (даже термодинамически устойчивых) эмульсий может происходить полное или частичное расслоение фаз. Так, в цельном молоке при его стоянии образуется слой сливок – всплывают наиболее крупные капельки жира. Для предотвращения этого процесса эмульсии (молоко) гомогенизируют – пропускают их через специальные устройства, диспергирующие капли до нужного размера.
Коалесценция лежит в основе деэмульгирования сырых нефтей, рафинирования растительных масел в маслоделии, пеногашения, плёнкообразования при нанесении лакокрасочных покрытий, микрокапсулирования и других процессов. Коалесценция капель воды – одна из причин выпадения атмосферных осадков (дождя, росы) из облаков и тумана.
седиментационная устойчивость определяется их дисперсностью, разность плотностей фаз, вязкостью среды.
Высокодисперсные эмульсии более устойчивы
Агрегативная устойчивость связана с концентрацией дисперсной фазы, с числом капель и частотой их столкновений. Разбавленные эмульсии могут существовать достаточно долго.
При диспергировании возникают эмульсии обоих типов, но "выживает" из них та, которая имеет более высокую агрегативную устойчивость, определяемую природой эмульгатора. Выбор эмульгатора определяется следующим эмпирическим правилом: эмульсии прямого типа (М/В) стабилизируют растворимыми в воде высокомолекулярными соединениями (например, белками) или водорастворимыми мылами (например, олеаты щелочных металлов). Эмульсии обратного типа (В/М) стабилизируют высокомолекулярными соединениями, растворимыми в углеводородах (например, полиизобутиленом), олеофильными смолами и мылами с поливалентными катионами (олеат кальция). Следовательно, эмульгатор должен иметь большее сродство к той жидкости, которая станет в эмульсии дисперсионной средой.
Эмульгаторы
растворимые ПАВ и ВМС
порошки гидрофильные или гидрофобные
Механизм стабилизации:
гидрофильные эмульгаторы
(ПАВ, порошки, смачиваемые водой: мел, гипс, глины) – стабилизация эмульсий прямого типа
Молекулы и частицы должны располагаться со стороны дисперсионной среды, т.е. на наружной стороне капель
гидрофобные (лучше растворимы в масле или порошки, которые смачиваются маслом: графит, угли, сажи, кинифоль) – обратные эмульсии
Эффективной стабилизации способствует определенная дисперсность порошка.
Эффективность любого эмульгатора оценивается по двум показателям:
устойчивость эмульсии, стабилизированной данным эмультагатором
по максимальному количеству эмульсии, которая м.б. стабилизирована определенной порцией эмульгатора.
Эмульгирующая способность порошков меньше, чем растворимых эмульгаторов и объясняется образованием структурно-механического барьера.
Наибольшее эмульгирующее действие у ПАВ с числом атомов С от 12 до 18 и сильной полярной группой (ионногенной).
Число ГЛБ = 10-18 – прямые эмульсии
Число ГЛБ = 3-8 – обратные эмульсии
ВМС (желатин, сапонин, ПВС) образуют трехмерные сетки
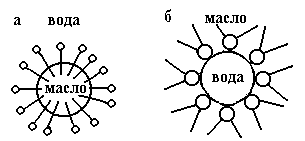
Рис.8.1. Защитные адсорбционные слои при образовании эмульсий: а) - (М/В), стабилизатор C17H35COONa; б) - (В/М), стабилизатор (C17H35COO)2Mg.
Особый случай представляет стабилизация эмульсий высокодисперсными порошками.
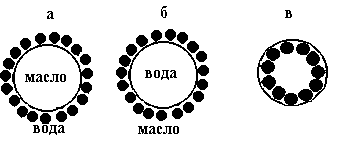
Такая стабилизация возможна при избирательном смачивании порошков. Они должны лучше смачиваться той жидкостью, которая станет дисперсионной средой. Так, для получения эмульсий (М/В) применяют порошки с гидрофильной поверхностью: мел, кварц, BaSO4 и др. Частицы порошка прилипают к поверхности капелек дисперсной фазы (см. рис 8.2 а), причем большая часть поверхности частиц будет находиться с внешней стороны капелек, так как порошок лучше смачивается водой.
При столкновении капелек, "бронированных" порошком, коалесценция не происходит, так как масло не может преодолеть слой порошка.
Если же твердый эмульгатор лучше смачивается неполярной жидкостью (сажа, сульфиды, парафин и др.), то по тем же причинам образуется эмульсия (В/М) (рис.8.2 б). Попытка же стабилизировать эмульсию (М/В) гидрофобным порошком, а эмульсию (В/М) - гидрофильным порошком не достигнет цели. Частицы порошка в этих случаях почти полностью втянуты внутрь капелек (рис.8.2 в): при столкновении таких капель будет происходить коалесценция.
Пользуясь эффективными, правильно выбранными эмульгаторами, можно получить эмульсии требуемого типа с концентрацией дисперсной фазы вплоть до 99%.
 Если
эмульгатор недостаточно эффективен,
то тип эмульсии, образующейся при
механическом диспергировании, зависит
главным образом от соотношения объёмов
фаз. Жидкость, содержащаяся в большем
объёме, обычно становится дисперсионной
средой.
Если
эмульгатор недостаточно эффективен,
то тип эмульсии, образующейся при
механическом диспергировании, зависит
главным образом от соотношения объёмов
фаз. Жидкость, содержащаяся в большем
объёме, обычно становится дисперсионной
средой.
Рис.8.2. Стабилизация эмульсий высокодисперсными порошками.
Эмульсию одного типа можно превратить в эмульсию противоположного типа, изменив природу эмульгатора. Это явление получило название обращение эмульсий (обращение фаз в эмульсиях). Например, эмульсию бензола в воде, стабилизированную олеатом натрия, легко превратить в эмульсию воды в бензоле. Для этого следует добавить в эмульсию соль многовалентного иона, например, хлористый кальций. В результате реакции образуется нерастворимый в воде олеат кальция, но который способен растворяться в бензоле и стабилизировать обратную эмульсию воды в бензоле.
Часто в практической деятельности человека возникает обратная задача: не стабилизировать эмульсии, а разрушать их. Например, сырая нефть – эмульсия воды в углеводородах, стабилизированная смолами и асфальтенами. Содержащаяся в нефти вода способствует коррозии трубопроводов, да и перекачивание воды вместе с нефтью экономически нецелесообразна.
Обычно в таких случаях применяют т.н. деэмульгаторы – это короткоцепочечные ПАВ. Они, обладая более высокой поверхностной активностью, чем эмульгаторы, способны адсорбироваться на поверхности частиц дисперсной фазы эмульсий и вытеснять молекулы эмульгаторов. Однако, деэмульгаторы не способны образовывать механически прочных адсорбционных пленок. При достаточно высокой концентрации деэмульгаторы разжижают упругие структурированные слои на поверхности частиц (устраняют структурно-механический фактор устойчивости систем), вызывая коагуляцию эмульсий.
1В более широком смысле под ползучестью понимают явление постепенного нарастания деформаций во времени при постоянном напряжении.
2Зимон А.Д., Лещенко Н.Ф. Коллоидная химия. М.: 1999, 316 С.
