
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2.4.5.5. Классификация изотерм адсорбции
Согласно Брунауэру, изотермы адсорбции газов и паров можно представить в виде следующих типов:
1 2 3
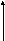
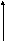
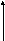


 А
А




1 1 р/ро
—мономолекулярная адсорбция, описывается уравнением Ленгмюра (Фрейндлиха, Темкина и т.д.)
— полимолекулярная адсорбция, уравнение БЭТ при С>20 (взаимодействие между адсорбентом и адсорбатом больше, чем между молекулами адсорбата на поверхности адсорбента
— полимолекулярная адсорбция, уравнение БЭТ при С<2 (взаимодействие между адсорбентом и адсорбатом меньше, чем между молекулами адсорбата на поверхности адсорбента.
4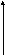 5 6
5 6



 А
А






1 1 1 р/ро
4 — =2, но осложненная капиллярной конденсацией, наблюдается петля адсорбционно-десорбционного гистерезиса
5 — =3, но осложненная капиллярной конденсацией, наблюдается петля адсорбционно-десорбционного гистерезиса
6 — такой вариант кривой возможен при строго послойной адсорбции.
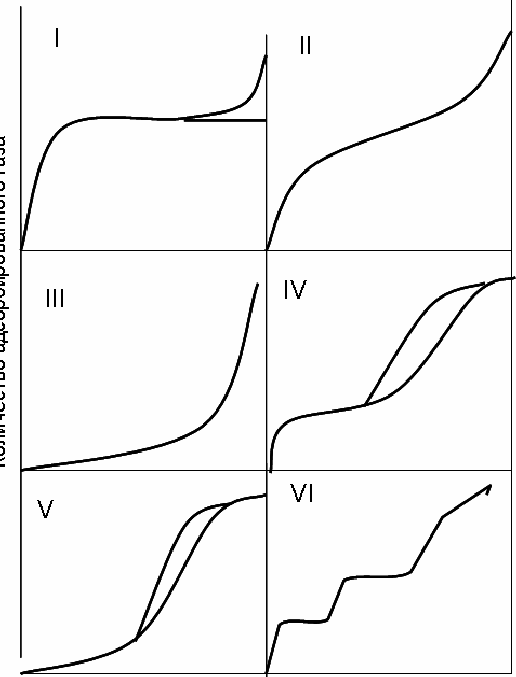
Рис.2.34. Изотермы полимолекулярной адсорбции
2.4.6. Адсорбция из растворов на твердых адсорбентах
2.4.6.1. Молекулярная адсорбция
Речь идет об адсорбции из растворов неэлектролитов или слабых электролитов. Эти вещества адсорбируются в виде молекул. Особенность такой адсорбции в том, что поверхность адсорбента заполнена молекулами растворителя или адсорбата. Растворенное вещество может адсорбироваться, только вытесняя из поверхностного слоя молекулы растворителя, при этом происходит обменнаяадсорбция.
(2.4.6.1.1.) Модель идеального двумерного раствора адсорбата и растворителя (этот материал не даю)
Существует ряд моделей адсорбции молекул из разбавленных растворов.
Первая модель предполагает, что адсорбция сводится в образованию монослоя, прилегающего к поверхности адсорбента. Остальные слои — обычный раствор. Этот случай напоминает хемосорбцию газов, но с небольшой теплотой адсорбции и приводит к описанию адсорбции уравнением Ленгмюра
(Г=Г∞ вс /1+ вс) или Фрейндлиха.
Вторая модель рассматривает адсорбцию как полимолекулярный слой, находящийся в монотонно спадающем потенциальном поле твердого адсорбента — уравнение БЭТ.
Модель идеального двумерного раствора адсорбата и растворителя предполагает:
поверхность однородна
площадь, занимаемая молекулой адсорбата равна площади, занимаемой молекулой растворителя
взаимодействие между всеми молекулами одинаковы
адсорбция мономолекулярна
Рассмотрим
обмен между молекулами как квазихимическую
реакцию:![]() с константой обмена.
с константой обмена.
Константа адсорбционного равновесия этой реакции (константа обмена) равна:
![]() (2.108)
(2.108)
В разбавленных растворах можно считать NA=const
![]()
![]() (2.109)
(2.109)
коэффициент активности равен произведению концентрации на коэффициент активности a=Nγ, , поэтому константа kа=k kγ. (k — концентрационная константа). Константу коэффициентов активности в разбавленном растворе можно считать равной единице: kγ=1, тогда:
![]() (2.110)
(2.110)
![]() — (2.111)
— (2.111)
общее уравнение изотермы адсорбции из бинарных растворов с константой обмена,
Анализ
уравнения показывает, что при NA
→0
![]() .
Рассмотрим графики изотерм адсорбции
компонента:
.
Рассмотрим графики изотерм адсорбции
компонента:
![]()





`````1
3
 2
2
1 NA
Рис. 2.35. Изотермы адсорбции растворенного компонента в растворе
Кривая 1 отвечает условию k >> 1 и полученное уравнение приобретает вид уравнения (при малых концентрациях растворенного компонента):
![]()
т.е.
рассмотренная модель приводит к уравнению
вида уравнения Ленгмюра:
![]()
При
k<<1
(кривая 2) получаем
уравнение вида
![]()
Если k≈1, т.е. величины сродства компонентов к адсорбенту близки, то на форму изотермы влияет коэффициент kγ.
Если поверхностный слой не идеален, то надо учитывать kγ адсорбата и растворителя. Если поверхность неоднородна, используют уравнения Темкина и Фрейндлиха.
продолжение, если не давать модель
