
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2.5.2. Краевой угол смачивания и работа адгезии
Уравнение Дюпре самостоятельно почти не используется для расчета Waиз-за трудности определения σт/ги σт/ж. Удобную для расчета этой величины форму имеет соотношение, полученное в результате сочетания уравнения Дюпре с законом Юнга. Если разность (σт/г - σт/ж) в уравнении Дюпре заменить на σж/гcosθуравнения Юнга, получимуравнение Дюпре — Юнга:
Wa= σж/г+ σж/гcosθ= σж/г(1+cosθ), (2.122)
в котором обе величины определяются экспериментально.
При рассмотрении смачивания поверхностей можно сделать следующие выводы:
Лиофильныеповерхности (гидрофильные, олеофобные)
Полное смачивание: θ = 0о; cosθ = 1,. Wa = Wк
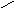
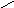
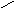
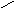
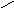

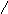

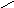
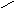

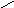
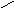
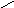
 Смачивание:
0о<θ=90о;
0<cosθ
<1;
1/2Wк
<Wa<
Wк
Смачивание:
0о<θ=90о;
0<cosθ
<1;
1/2Wк
<Wa<
Wк
Лиофобныеповерхности (гидрофобные, олеофильные)
П олное
несмачивание:
олное
несмачивание:
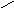


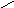
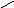 θ
= 180о;
cosθ
= -1,. Wa
= 0
θ
= 180о;
cosθ
= -1,. Wa
= 0
Н есмачивание:
90о<θ=180о;
-1<cosθ<0;
1/2Wк<Wa<1/2Wк
есмачивание:
90о<θ=180о;
-1<cosθ<0;
1/2Wк<Wa<1/2Wк


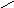
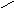

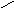
Разберем, почему органические жидкости смачивают любые поверхности:
а )
работа когезииводы
Wк
= 2 σж/г≈ 144 мДж/м2
)
работа когезииводы
Wк
= 2 σж/г≈ 144 мДж/м2
В когезионные силы воды входят все виды В—д—В взаимодействия, водородные связи, поэтому вода будет хорошо смачивать полярные поверхности (например, стекло), с которыми у нее будут сильные взаимодействия, в этом случаеWк ≈Wa.;
с неполярными поверхностями(парафин) взаимодействие молекул воды ограничивается только теми силами, которые действуют внутри неполярной фазы, т.е. дисперсионными (+ индукционными), поэтомуWa<<Wк Н2О
б) для неполярной органической жидкости Wк = 2σж/г≈ 45 мДж/м2, поэтому для любой поверхности такая работа когезии одного порядка с работой адгезии между контактирующими фазами.
Лучше смачивает данную поверхность та жидкость, которая ближе по полярности к смачивающему веществу.
Чем выше полярность жидкости, тем слабее ее смачивающие свойства: ртуть смачивает только некоторые металлы, вода — полярные поверхности, органические жидкости — любые поверхности.
2.5.3. Избирательное смачивание
При нанесении на поверхность двух жидкостей, нерастворимых друг в друге, между ними образуется краевой угол, характеризующий относительную способность этих жидкостей смачивать данное тело. Т.е. проявляется избирательность смачивания.
Для сравнительной оценки смачиваемости поверхности сопоставление проводят по сравнению с водой, если угол 0< θ<90о со стороны полярной жидкости (Н2О), то поверхностьгидрофильна.Гидрофильные поверхности — оксиды, гидроксиды, соли и т.д.
Если угол θ<90о со стороны углеводорода, то поверхностьгидрофобна. Схематически избирательное смачивание можно проиллюстрировать так:


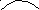
 С6Н6Н2О Н2О
С6Н6Н2О Н2О
С


 6Н6
6Н6
Гидрофильная пов. Гидрофобная пов.
Рис.2.42. Схематическое изображение избирательного смачивания
На избирательном смачиванииосновано явлениефлотации. Флотация — избирательное смачивание. Частицы не тонут, если они гидрофобны, т.е. испытывают влияние флотационной силы, направленной перпендикулярно поверхности жидкой фазы. Ее действие направлено вверх; если частицы смачиваются водным раствором, флотационная сила направлена вниз, поэтому частицы тонут.
