
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
5.4. Факторы, влияющие на величину ζ-потенциала:
В общем случае - потенциал всегда меньше потенциала - на границе адсорбционного и диффузного слоев, но для упрощения обычно принимают, что плоскость скольжения проходит именно по границе адсорбционной и диффузной частей ДЭС и = . Таким образом, все факторы, влияющие на и толщину диффузного слоя, изменяют и - потенциал. Так, согласно уравнениям (5.1) и (5.2), понижение температуры, введение в систему индифферентного электролита (ионы, которого не способны достраивать кристаллическую решетку) и увеличение заряда его ионов ведут к уменьшению толщины диффузного слоя, снижению и - электрокинетического потенциала. Рассмотрим подробнее влияние этих факторов.
1. Влияние индифферентных электролитов (не изменяющих φо-потенциал), не содержащих ионы, входящие в состав решетки твердой фазы:
А) в состав входят ионы, сходные с противоионами исходного ДЭС
↑Со =→ ↓δ (сжатие) =→ ↓ ζ-потенциал (кривая 1)
Влияние концентрации такого электролита на величину - потенциала иллюстрирует рис.5.4.

Рис.5.4. Влияние концентрации - С индифферентного электролита на - потенциал мицелл.
Увеличение концентрации от C1 до C3 уменьшает толщину диффузного слоя (ионы из него переходят в адсорбционный слой) от 1 до 3 и - значение - потенциала от 1 до 3. При C4 двойной электрический слой состоит лишь из слоя Гельмгольца и - потенциал равен нулю. Такое состояние коллоидной системы называют изоэлектрическим, а формула ДЭС мицеллы (5.3) в этом случае имеет вид:
{m[AgJ] nJ- nK+}0
Коллоидные системы, находящиеся в изоэлектрическом состоянии, не участвуют в электрокинетических явлениях.
Б) Влияние электролитов, не имеющих общих ионов с противоионами ДЭС мицелл.
Закономерности влияния концентрации таких электролитов на - потенциал мицелл аналогичны рассмотренным: с увеличением С электрокинетический потенциал уменьшается вплоть до нуля (изоэлектрического состояния).

Рис.5.5. Влияние концентрации электролитов на - потенциал: 1 – KCl, 2 – CaCl2, 3 –FeCl3 , 4 – ThCl4
При этом ионы добавленного электролита могут вытеснять противоионы адсорбционного слоя ДЭС, замещая их (обменная адсорбция). Особенно свойственно данное явление индифферентным многовалентным ионам, таким как Al+3, Th+4, (РО4)-3, а также - органическим ионам. Они при одинаковой концентрации снижают - потенциал значительно сильнее, чем рассмотренные выше однозарядные противоионы K+ или NO3- (рис.5.5).
 Это
объясняется тем, что многозарядные ионы
обладают большей адсорбционной
способностью, сильнее притягиваются
заряженным ядром мицеллы. Войдя в
адсорбционный слой ДЭС, они компенсируют
сразу несколько зарядов поверхности,
вызывая изоэлектрическое состояние
при существенно меньших концентрациях,
чем одновалентные ионы. Они способны
не только полностью скомпенсировать
заряд ядра, но и перезарядить коллоидные
частицы (рис. 5.6).
Это
объясняется тем, что многозарядные ионы
обладают большей адсорбционной
способностью, сильнее притягиваются
заряженным ядром мицеллы. Войдя в
адсорбционный слой ДЭС, они компенсируют
сразу несколько зарядов поверхности,
вызывая изоэлектрическое состояние
при существенно меньших концентрациях,
чем одновалентные ионы. Они способны
не только полностью скомпенсировать
заряд ядра, но и перезарядить коллоидные
частицы (рис. 5.6).
Рис.5.6. Падение потенциала в пределах двойного электрического слоя при перезарядке частицы мицеллы
Ионы одинаковой валентности снижают электрокинетический потенциал в соответствии с их радиусом. Так, известны следующие ряды понижающего действия концентрации ионов на - потенциал:
Li+< Na+< K+< Rb+
Mg+2< Ca+2< Sr+2< Ba+2
Ионы с малым радиусом слабее поляризуются, сильнее гидратируются и поэтому труднее входят в адсорбционную часть ДЭС (для этого им нужно сбросить часть «гидратной шубы», а этот процесс энергетически не выгоден) и в меньшей степени снижают - потенциал.
2. Влияние неиндифферентных электролитов (способных изменять φо-потенциал), содержащих ионы, которые могут входить в состав решетки твердого тела):
А) ион, способный входить в состав решетки твердого тела имеет тот же знак, что и φо-потенциал
.

Рис.5.7. Зависимость электрокинетического потенциала от концентрации неиндифферентных ионов
Например, потенциалопределяющими ионами мицеллы {m[AgJ]nAg+(n-x)NO3-}+xNO3- служат неиндифферентные ионы Ag+, и мы добавляем в систему раствор-электролит AgNO3.
При малых концентрациях электролита с увеличением концентрации С электрокинетический потенциал растет за счёт повышения потенциала поверхности 0при адсорбции на ней неиндифферентных ионов.
При повышенных концентрациях электролита преобладающим становится влияние ионов NO3-, введенных вместе с неиндифферентными - противоионами ДЭС. Они сжимают диффузный слой, вызывая снижение- потенциала. По этой причине в данном случае зависимость электрокинетического потенциала мицелл от концентрации неиндифферентных ионов имеет экстремум (рис. 5.7).
Б) Влияние электролита, содержащего неиндифферентные ионы противоположные по знаку потенциалопределяющим ионам мицеллы.
Например, к системе мицелл {m[AgJ]nAg+(n-x)NO3-}+хxNO3-прибавляют электролит KJ, содержащий неиндифферентные ионы J-, противоположные по знаку потенциалопределяющим ионам Ag+.
В этом случае адсорбция ионов йода на поверхности агрегата приведёт к снижению 0потенциала поверхности и тем самым – к снижению и- потенциала. Это видно из рис. 5.8. На нём увеличение концентрации электролита от С1до С3приводит к снижению0потенциала от01до03, а-потенциала – от1 до3.
В предельном случае при С4возможна перезарядка коллоидной частицы -4 при04.
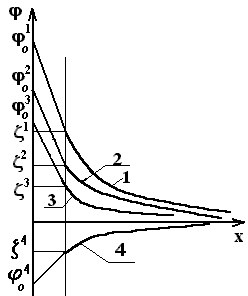
Рис. 5.8. Падение потенциала в пределах ДЭС мицелл при различных концентрациях неиндифферентных ионов:С4 > С3> C2 > C1
(случай 2)
