
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
4. Поляризация поверхности за счёт внешнего электрического поля.
Так происходит поляризация ртутного электрода, погруженного в раствор – электролит.
5.3. Строение дэс
Современная теория строения ДЭС (развитая в работах Гуи(*), Чапмена(*), Штерна(*), Фрумкина(*), Грэма(*), Гельмгольца(*)) основана на анализе электростатического взаимодействия ионов в ДЭС в сопоставлении с межмолекулярном взаимодействием и тепловым движением ионов.
Согласно этой теории, на поверхности частиц дисперсной фазы возникает заряд вследствие адсорбции потенциалопределяющих ионов или поверхностной ионизации.
В случае адсорбции потенциалобразующих ионов(правило Панета – Фаянса) величина и знак полного термодинамическогопотенциала φона поверхности частиц дисперсной фазы зависит от количества и знака адсорбированных ионов. Этот потенциал притягивает противоположно заряженные ионы в растворе.
Одна часть противоионов примыкает непосредственно к заряженной поверхности, образуя плотный (адсорбционный) слой – слой Гельмгольца,толщина плотного слояdпринимается равной радиусу гидратированного противоиона. Эту часть ДЭС можно рассматривать как плоский конденсатор, в котором потенциал, как известно, снижается линейно.
![]() (5.1)
(5.1)
Другая часть противоионов под действием теплового движения распространяется вглубь фазы, образуя так называемый диффузный слой, или слой Гуи.
Образовавшийся плоский конденсатор необычен. Расстояние между его "обкладками" равно радиусу ионов, то есть стомиллионным долям сантиметра. Если разность потенциалов равна одному вольту, то напряженность электрического тока достигает при этом миллиона вольт на сантиметр. Это очень высокая напряженность. Даже в мощных электростатических ускорителях заряженных частиц она гораздо меньше. Естественно предположить, что при такой высокой напряженности электрического поля реакционная способность веществ меняется, изменяются вообще химические свойства вещества. На катоде такие поля способны извлечь электроны из металлов и вызвать нейтрализацию катионов. А на аноде они обусловливают начальный акт растворения - переход металла из кристаллической решетки в двойной слой в виде ионов.
В диффузном слоепротивоионы распределены неравномерно, поэтому потенциал в диффузной части слоя снижается с расстоянием по экспоненте.
= e-Х/ (5.2)
где - потенциал на границе адсорбционного и диффузного слоев; x - расстояние от начала диффузной части ДЭС в глубину жидкой фазы; δ - толщина диффузной части слоя.
За толщину диффузной части слоя δ принимают расстояние, на котором уменьшается вераз(/е).Из теории Штерна оно равно:
![]()
(5.3)
I = ½ Cizi2
- относительная диэлектрическая проницаемость среды, F - постоянная Фарадея, I - ионная сила раствора, Ci- концентрация i – го иона в растворе, zi - заряд иона.
Из уравнения (5.3) следует, что δ уменьшается с ростом концентрации электролита, заряда его ионов и с понижением температуры.
Экспериментальных методов измерения 0не существует.
За толщину диффузной части δслоя принято расстояние, на которомφо уменьшается вераз.
Толщина
диффузной части уменьшается при
увеличении концентрации ионов электролита
(cio),
заряда его ионов (zi)
и с понижением температуры (Т):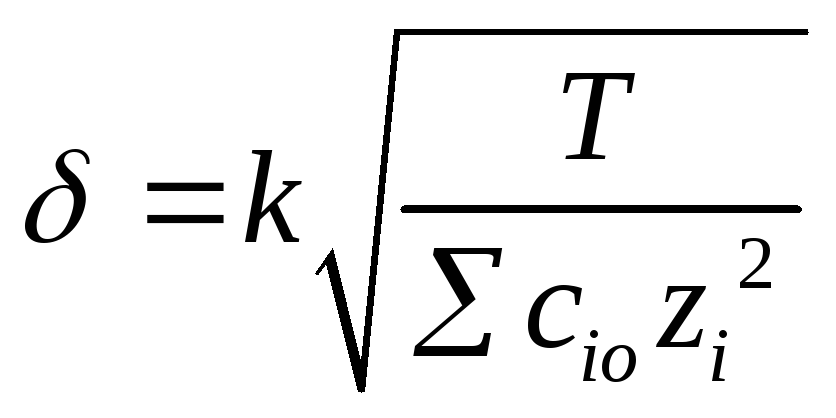
![]() (k– коэффициент пропорциональности,
включающий диэлектрические постоянные
среды и вакуума, универсальную газовую
постояннуюRи число
ФарадеяF). Значенияδдля сильно разбавленных растворов
электролитов составляют десятки
нанометров, т.е. намного превосходят
размеры молекул и ионов в растворе.
(k– коэффициент пропорциональности,
включающий диэлектрические постоянные
среды и вакуума, универсальную газовую
постояннуюRи число
ФарадеяF). Значенияδдля сильно разбавленных растворов
электролитов составляют десятки
нанометров, т.е. намного превосходят
размеры молекул и ионов в растворе.
Суммарный заряд противоионов адсорбционного слоя не полностью компенсирует заряд поверхности частицы, и на границе раздела адсорбционного и диффузного слоев существует заряд, обуславливающий существование потенциала Штерна (φd- потенциала).
Строение диффузной части ДЭС определяется соотношением потенциальной энергии притяжения противоионов к заряженной поверхности и кинетической энергии их теплового движения.
Схематическое распределение потенциала в ДЭС см. на рис.5.2:
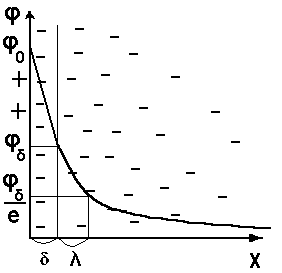
Рис.5.2. Схема распределение потенциала в ДЭС
При относительном перемещении фаз происходит разрыв двойного электрического слоя по плоскости скольжения. Разрыв ДЭС может произойти даже вследствие броуновского движения частиц дисперсной фазы. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остается в дисперсионной среде. В результате дисперсионная среда и дисперсная фаза оказываются противоположно заряженными.
Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называют электрокинетическим потенциалом или ζ(дзета)-потенциалом.
В общем случае ζ-потенциал всегда меньше φd – потенциала, но для упрощения обычно принимают, что плоскость скольжения делит адсорбционную и диффузную части ДЭС и ζ = φd.
Значение электрокинетического потенциала определяют, изучая электрокинетические явления (обычно электроосмос и электрофорез). Дзета- потенциал, возникающий при электроосмосе или электрофорезе, рассчитывают по уравнению Гельмгольца – Смолуховского
![]()
![]() (5.4)
(5.4)
или
![]() ,
(5.5)
,
(5.5)
где η – вязкость среды; Uo – линейная скорость движения фаз; Е – напряженность электрического поля; Uэф – электрофоретическая подвижность, она равна:
![]() .
(5.6)
.
(5.6)
Здесь L – расстояние между электродами: V – разность потенциалов: а – сдвиг границы золь – контактная жидкость за время t.
ζ-потенциал – важнейшая характеристика, поскольку определяет скорость перемещения частиц дисперсной фазы и дисперсионной среды и устойчивость золей.
Строение ДЭС можно записать в виде формулы мицеллы золя. Мицелла – электрически нейтральная коллоидная частица.
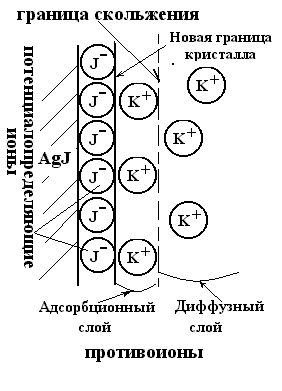
Например, получение золя иодида серебра:
AgNO3 + KJ = AgJ + KNO3
 производят
в избытке либоAgNO3,
либоKJ.
производят
в избытке либоAgNO3,
либоKJ.
Рис.5.3. Двойной электрический слой мицеллы AgJ, полученной при избытке KJ.
Стабилизатором частиц в этом случае выступает ДЭС, образованный неиндифферентными ионами Ag+или J-и противоионамиK+илиNO3-Например, при избытке в растворе ионов иода последние являются неиндифферентными и потенциалопределяющими. Адсорбируясь на поверхности кристаллаAgJ, они достраивают кристаллическую решётку и заряжают поверхность своим знаком заряда. В роли противоионов выступают ионы калия, часть которых будет находиться в адсорбционном слое, а другая часть - в диффузном слое.
Для такой системы формулу ДЭС записывают следующим образом:
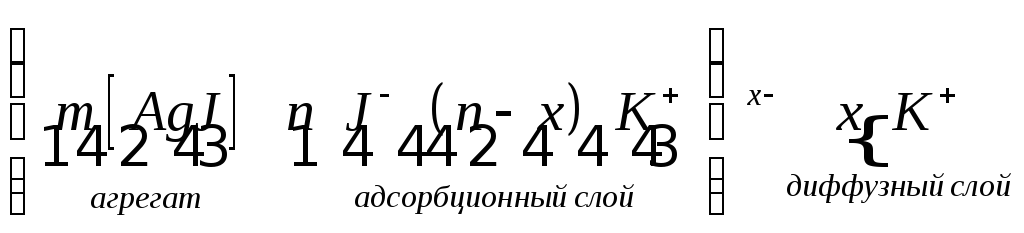 ,
где m>>n
,
где m>>n
|← ядро |
|←коллоидная частица с зарядом (-х)|
|← мицелла (электронейтральна) →|
Коллоидную частицу вместе с двойным электрическим слоем называют мицеллой. Внутреннюю часть мицеллы составляет агрегат - микрокристалл AgJ, состоящий из m пар ионов Ag+ и J-. Агрегат вместе с n потенциалопределяющих ионов (здесь J-) составляет ядро мицеллы. Ядро мицеллы и (n-x) противоионов плотной (адсорбционной) части ДЭС образуют гранулу или частицу. Гранулу окружают x противоионoв диффузного слоя.
Если же указанная система получена при избытке нитрата серебра, то неиндифферентными и потенциалопределяющими являются ионы Ag+, и формула мицеллы (строение двойного электрического слоя) имеет вид:
{m[AgJ] nAg+ (n-x)NO3-}x+ xNO3-
Мицелла гидрофобного золя BaSO4, стабилизированного BaCl2:
{m [BaSO4] n Ba2+ 2(n-х)Cl-} 2х Cl-
