
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
А) теория Поляни(*)
Возможность образования полимолекулярных слоев в пористых адсорбентах рассматривается в потенциальной теории Поляни.
Эта теория была предложена для термодинамического описания полимолекулярной адсорбции. Она устанавливает связь величины адсорбции с давлением адсорбата и дифференциальной теплотой адсорбции. Наиболее удачно она предсказывает зависимость величины адсорбции как функции температуры.
Теория не приводит к конкретным уравнениям, но широко используется для описания адсорбции на пористых адсорбентах, т.к. часто эта зависимость А=f(Р) имеет вид:
А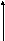



1 Р/Ро
Рис. 2.23. Изотерма полимолекулярной адсорбции
Основные положения теории Поляни:
Адсорбция обусловлена чисто физическими силами взаимодействия.
В адсорбционном пространстве действуют только дисперсионные силы, не зависящие от температуры. На поверхности адсорбента нет активных центров, а адсорбционные силы образуют около поверхности адсорбента непрерывное силовое поле. Адсорбционные силы действуют на расстоянии, большем, чем диаметр отдельной молекулы.
При адсорбции характер взаимодействия между молекулами адсорбата не изменяется, а происходит увеличение его плотности на поверхности адсорбента. Силы по мере удаления от поверхности на некотором расстоянии от нее становятся равными 0.
2. Всё адсорбированное вещество на поверхности находится в жидком состоянии. Объём, занимаемый адсорбатом, равен
Vж.адс.=АVм . (2.74)
3. За меру интенсивности адсорбционного взаимодействия принят адсорбционный потенциал, работа переноса 1 моль газа с поверхности жидкого адсорбата (ро) в равновесную газовую фазу (р):
 , (2.75)
, (2.75)
он характеризует работу против внешних вил.
С приближением к поверхности адсорбента адсорбционные возрастают, а потом уменьшаются, доходя до 0 и переходя в силы отталкивания. Таким образом создаётся адсорбционное поле, каждой точке которого соответствует определенное значение адсорбционного потенциала ε.
Молекулы газа, попадая в адсорбционное поле, притягиваются поверхностью адсорбента. Образуется полимолекулярный слой, плотность которого уменьшается по мере удаления от поверхности.
Адсорбционный слой напоминает атмосферу: вблизи поверхности твердого тела он сжат, а в наружных слоях — разрежен. Представление о потенциальном поле дают эквипотенциальные поверхности
![]()

 поверхности
одинакового потенциала
поверхности
одинакового потенциала
Расстояние между каждой парой эквипотенциальных поверхностей соответствует некоторому объёму, поэтому между потенциалом ε и V существует определенная зависимость.
В адсорбционном пространстве действуют дисперсионные силы, которые не зависят от температуры. Каждой точке изотермы адсорбции соответствуют определенные значения А и Р/Ро, котораяпозволяет получать значения ε и V, зависимость ε=f(Т) и заменить зависимость ε=f(r) на ε=f(Vж.адс.). Зависимость ε=f(r) называется потенциальной кривой адсорбции. Ее можно построить, исходя из экспериментально полученной изотермы адсорбции, зная распределение Vж.адс по адсорбционному пространству:
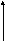
ε


V
Рис. 2.24. Потенциальная кривая адсорбции
Пользуясь этой зависимостью, можно построить изотерму при любой температуре, получив изотерму адсорбции при одной температуре Т1.
Так
как дисперсионные силы не зависят от
температуры, то от температуры не должна
зависеть и форма потенциальной кривой
адсорбции, что подтверждается и
экспериментально. Экспериментальные
точки при разных температурах ложатся
на одну и ту же зависимость
ε=f(Vж.адс.),
которую называют характеристической
кривой:
![]() .
(2.76)
.
(2.76)
Для двух температур: V=А1VМ1 = А2VМ2 (2.77)
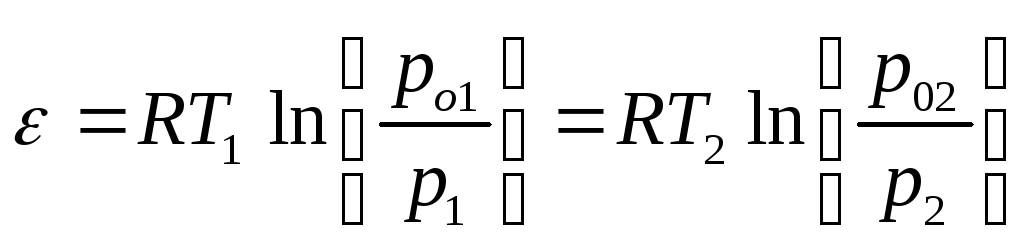 (2.78)
(2.78)
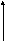
а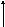
 lnP
lnP

 Т1 α α=-qst/R
Т1 α α=-qst/R


 Т2
Т2


Р 1/T
![]() ,
исходя из
уравнения Клаузиуса—Клапейрона(33,34)
,
исходя из
уравнения Клаузиуса—Клапейрона(33,34)
![]() (2.79)
(2.79)
Рис.2.25. Построение и расчент изотерм адсорбции из одной изотермы по теории Поляни
Важное свойство было обнаружено Дубининым(*):
Характеристические кривые для одного и того же адсорбента и разных адсорбатов при всех значениях объёма адсорбата в поверхностном слое находятся в постоянном соотношении: β=(ε/ εо)V, где β — коэффициент аффинности.
Отсюда следует, что, зная характеристическую кривую для одного адсорбата и β для другого по отношению к первому, можно вычислить изотерму адсорбции для 2-го адсорбата на том же адсорбенте.
Теория Поляни не дала математического выражения для изотермы адсорбции, однако ее представления положены в основу и используются современной теорией объёмного заполнения пор молекулами адсорбата. Она не потеряла практического значения и остается теорией, пригодной для описания адсорбции на адсорбентах с резкой энергетической неоднородностью (на углях).
Мы познакомились с двумя теориями адсорбции газов и паров на поверхности твердых адсорбентов — Ленгмюра и Поляни, очень по-разному подходящих к рассмотрению этого процесса. Возникает вопрос, какой отдать предпочтение. Обе они ограничены в применении.
Теория Поляни применима к физической адсорбции молекул адсорбата, теория Ленгмюра охватывает с известными ограничениями и физическую, и химическую адсорбцию адсорбата. Однако она не может быть применима для объяснения адсорбции на пористых адсорбентах с мелкими порами из-за резкой энергетической неоднородности поверхности. Делались попытки обобщить представления Ленгмюра и Поляни. Такая обобщенная теория была развита Брунауэром, Эмметом(*)и Теллером в 1935-40-х гг. прошлого века применительно к адсорбции паров.
.
б)Теория БЭТ
Брунауэр, Эммет и Теллер создали наиболее общую теорию полимолекулярной адсорбции, в которой описание процессов адсорбции увязывается с представлениями и методами статистической физики.
Авторы теории на основе уравнения Ленгмюра получили приближенное уравнение полимолекулярной адсорбции, которое широко применяется для определения удельной поверхности адсорбента и теплоты адсорбции.
В теории рассматривается адсорбция паров и газов при Т< Ткр.с образованием полимолекулярного слоя вещества на поверхности адсорбента. При Р=Роидет конденсация пара.
Уравнение Ленгмюра можно использовать только при отсутствии адсорбции веществ сверх монослоя. Это строго: при хемосорбции, физической адсорбции газов при малых Р и Т>Ткри адсорбции веществ из растворов. Чаще образуются полислои.
