
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
Основные положения теории бэт
поверхность энергетически однородна
адсорбция локализована
теплота адсорбции во 2 ,3 ……nслоях постоянна и равна теплоте конденсации: ∆Надс2 ,3 ……n=constи = ∆Нконд

А



1 Р/Ро
Теория предполагает образование полислоя на поверхности адсорбента, но из понятия однородности поверхности следует, что друг с другом молекулы адсорбата не должны взаимодействовать. Можно заранее сказать, что уравнение БЭТ строго описывает адсорбцию только в монослое.
Вывод уравнения ( не даю)
В теории БЭТ сделано предположение т образовании на поверхности адсорбента последовательных комплексов центров адсорбции с 1,2,3 и т.д. молекулами адсорбата.
Процесс адсорбции можно представить в виде последовательных квазихимических реакций:
А + В = АВ АВ + В = АВ2 АВ2 + В = АВ3
Константы равновесия для этих реакций соответственно равны:
![]()
![]()
![]() (2.80)
(2.80)
где Ао — концентрация свободных центров.
Для концентрации соответствующих комплексов можно записать:
[АВ] = Кр Ао Р (2.81)
[АВ2] = К1 [АВ] Р = К1 Кр Ао Р2 (2.82)
[АВ3] = К2 [АВ2] Р = К1 К2Кр Ао Р3 (2.83)
Авторы приняли, что во всех слоях, кроме 1-го, молекулы адсорбата взаимодействуют между собой как при конденсации, и следовательно:
![]() k1
=
k1
=![]() k2
= kL
=
k2
= kL
=![]() Aж/Aп
= 1/Pо (2.84)
Aж/Aп
= 1/Pо (2.84)
Для упрощения введем обозначение:
![]()
![]() ,х=р/ро
(2.85)
,х=р/ро
(2.85)
постоянная с характеризует разность ∆G (энергии Гиббса) процессов адсорбции и конденсации.
![]()
![]()
![]() (2.86)
(2.86)
или возвращаясь к предыдущему:
[АВ] = Ао с х (2.87)
[АВ2] = Ао с х2 (2.88)
[АВ3] = Ао с х3 … и т.д. (2.89)
Общее число центров:
А∞= Ао + [АВ] + [АВ2] + [АВ3] …= Ао + Аос х + Аос х2+ Аос х3 …= Ао [1 + сх + (1 + х + х2…) ] (2.90)
В круглых скобках имеем геометрическую прогрессию, которую при х<1 равна
∑ = 1/(1—х), отсюда:
![]() (2.91)
(2.91)
Величина адсорбции молекул адсорбата :
А = [АВ] + 2[АВ2] + 3[АВ3] +…= Аос х (1 + 2х + 3х2…) ] (2.92)
Ряд 1 + 2х + 3х2можно представить как производную от выражения (1 + х + х2…):
1 + 2х + 3х2= (1 + х + х2…)′ (2.93)
∑ 1 + 2х + 3х2= 1/(1—х)2(2.94)
подставляя в
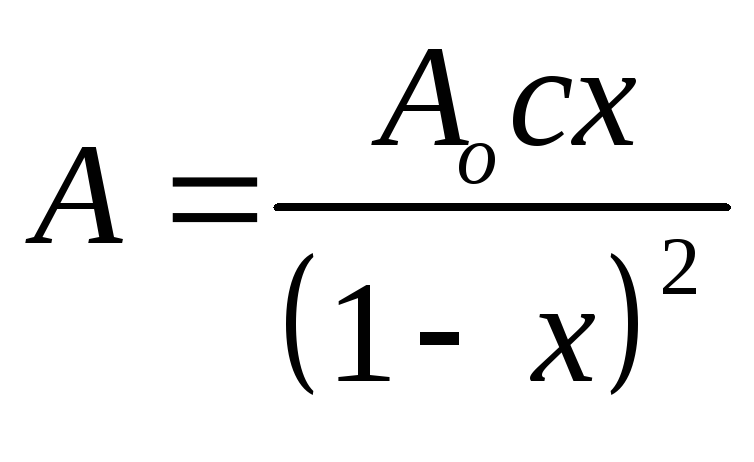 значения дляАо ис,получаем выражение,
значения дляАо ис,получаем выражение,
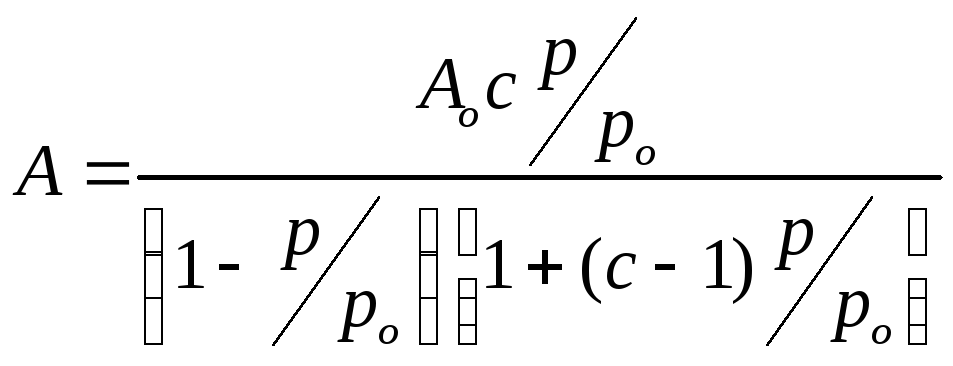 (2.95)
(2.95)
Обычно уравнение БЭТ представляют в следующем виде:
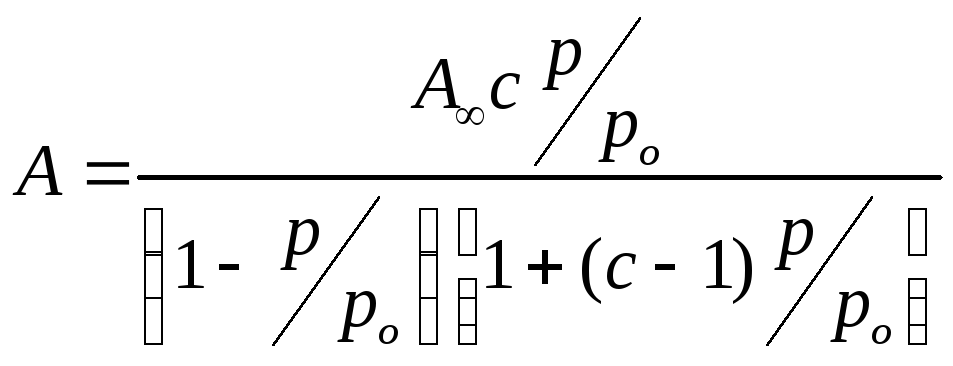 (2.96)
(2.96)
оно содержит две константы А∞ — фактически емкость монослоя и с, которая равна отношению констант адсорбции к константе конденсации (с= k адс/ k конд.).
Анализ уравнения приводит к следующим выводам:
При р/ро много <1 получаем А= А∞с р/ро — линейная зависимость, предельный случай, закон Генри. (Уравнение БЭТ переходит в уравнение Ленгмюра, а затем в закон Генри).
Экспериментальные данные по адсорбции согласуются с теорией тем лучше, чем больше значения с и теплоты адсорбции. Этому способствует увеличение сродства адсорбата к адсорбенту и уменьшению взаимодействия между молекулами адсорбата.
Уравнение БЭТ лучше описывает адсорбцию в интервале давлений адсорбата: 0,05 < р/ро <0,3. Меньшая величина связана с искажениями, вносимыми неоднородностью поверхности, большая — связана с взаимодействиями между молекулами адсорбата. Поэтому уравнение, выведенное для полимолекулярной адсорбции газов, лучше всего описывает мономолекулярную адсорбцию.
Для
точного определения А∞
и с
используют линейную форму
уравнения: 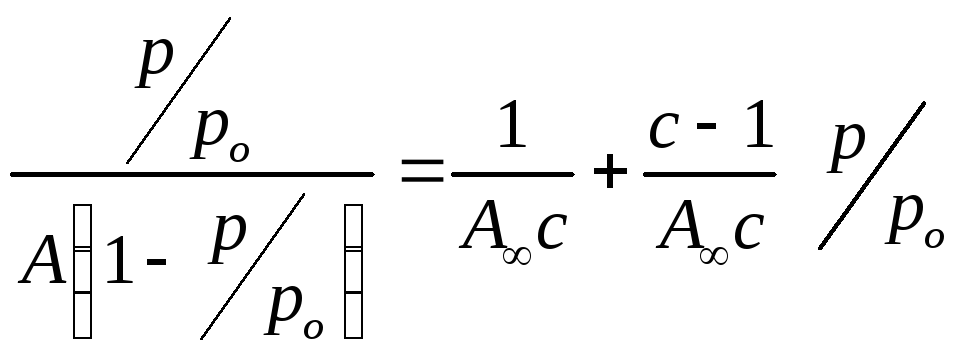 (2.97)
(2.97)
следовательно, графически экспериментальные данные в соответствующих координатах описываются линейной зависимостью:
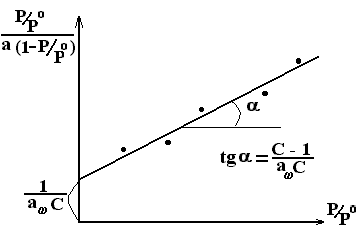
\
Рис. 2.27. Линейный график уравнения БЭТ
Из системы двух уравнений с двумя неизвестными легко определить искомые величины А∞ и С.
На теории БЭТ основан стандартный метод измерения удельной поверхности адсорбентов, катализаторов, порошков и т.д.
В качестве адсорбатов используют с этой целью инертные газы (N2, Kr, Ar), которые проявляют слабое межмолекулярное взаимодействие на поверхности адсорбента. Для увеличения адсорбции таких газов ее ведут при низких температурах (низкотемпературная адсорбция).
Предложено много модификаций теории БЭТ, но они описывают только частные варианты. Трудно исправить недостатки, не нарушив простоты вывода и пользования — явных достоинств этой теории.
Адсорбция газов и паров на пористых адсорбентах
Характеристика твердых адсорбентов
Твердые адсорбенты — это природные или искусственные материалы с большой наружной или внутренней поверхностью, на которой происходит адсорбция газов или растворов.
Развитой поверхностью обладают порошки и пористые тела — угли, силикагели.
