
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
6.4.2. Кинетика электролитной коагуляции
Устанавливает закономерности электролитной коагуляции во времени.
основная характеристика – скорость коагуляции Vк .
V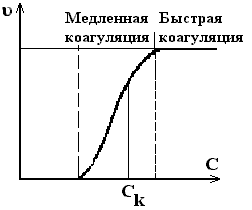 к
– изменение
общего числа частиц дисперсной фазы в
единицу времени в единице объема: Vк
= -
к
– изменение
общего числа частиц дисперсной фазы в
единицу времени в единице объема: Vк
= - ![]()
Ход коагуляции в зависимости от С коагулирующего электролита можно разделить на 2 стадии: медленную и быструю
Рис.6.6. Зависимость скорости электролитной коагуляции от концентрации электролита
Концентрация электролита, начиная с которой скорость не зависит от концентрации, называется порогом быстрой коагуляции. Быстрая коагуляция начинается при ΔU=0.
Если ΔU >кТ частиц, то коагуляция происходит за счет особо активных, энергия которых больше ΔU – медленная коагуляция.
При ΔU =0 – быстрая коагуляция.
Кинетика быстрой коагуляции разработана Смолуховским.
Приняв кинетические закономерности коагуляции аналогичными реакции второго порядка, в элементарном акте которой участвуют две частицы, Смолуховский получил уравнение для расчета числа частиц, оставшихся в золе ко времени t:
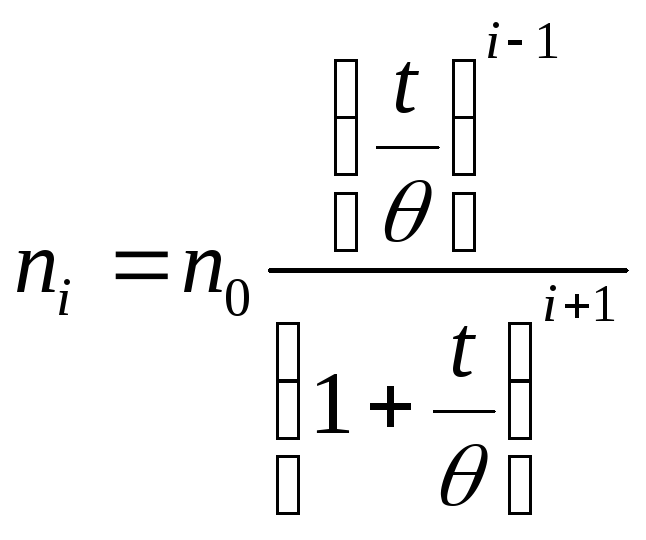 ,
(6.5)
,
(6.5)
где n0 — первоначальное число частиц; i — порядок частиц (одиночные, двойные, тройные и т. д.); t - время от начала коагуляции; - время половинной коагуляции, т.е. время, в течение которого число частиц уменьшается в два раза.
Суммарное число частиц n всех кратностей, оставшихся в золе ко времени t, выражается уравнениями:
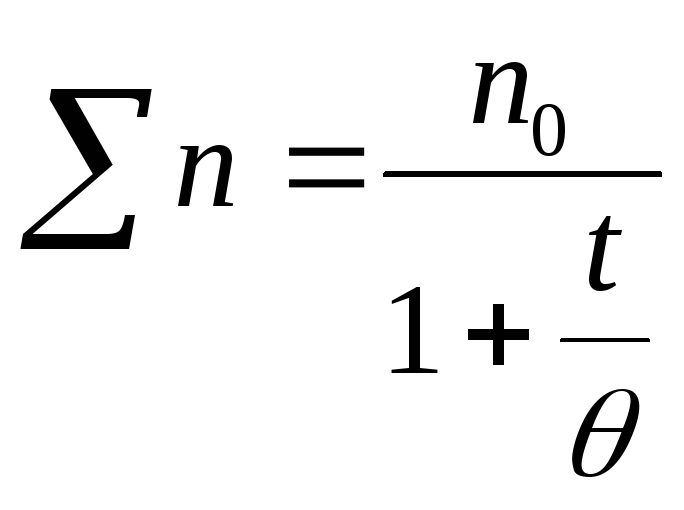 или
или
![]() ,
(6.6)
,
(6.6)
где k — константа скорости коагуляции, при t = n = n0/2. Величины k и связаны между собой соотношением
![]() (6.7)
(6.7)
На рис. 6.7. представлены кривые, показывающие изменение во времени относительного числа частиц различной кратности в процессе коагуляции. Как видно из рисунка, общее число частиц непрерывно уменьшается, причём число одинарных частиц уменьшается с максимальной скоростью. Число двойных, тройных и т.д. частиц проходит через максимум (в начальный момент их не было в системе), причём высота максимума падает с увеличением кратности.
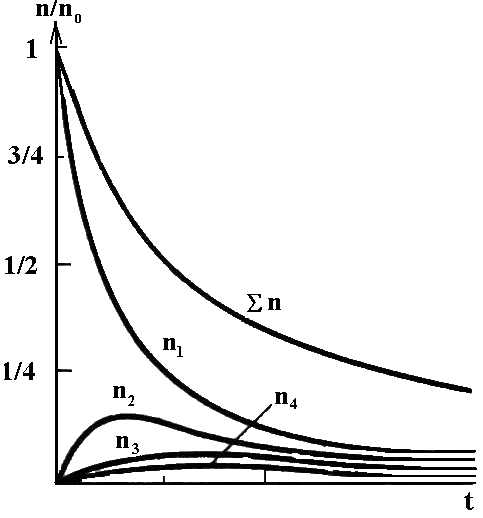
Рис. 6.7. Кинетические кривые изменения относительного числа частиц различной кратности во времени в процессе коагуляции
Принимая, что ΔU =0, все соударения эффективны, теория дает для константы скорости быстрой коагуляции выражение:
Кб
= ![]() (6.8)
(6.8)
Впоследствии теория Смолуховского была блестяще экспериментально подтверждена и развита другими учеными: Зигмонди(*), Мюллером(*).
В частности, в теории быстрой коагуляции полидисперсных золей Мюллером было объяснено, почему полидисперсные золи коагулируют быстрее монодисперсных. Крупные частицы выступают в виде зародышей коагуляции, в их присутствии маленькие частицы исчезают быстрее, чем в их отсутствии.
Если U 0 и P 1, то не все соударения частиц эффективны, в этом случае происходит медленная коагуляция.Кинетика медленной коагуляции развита Н. А. Фуксом(*) во время его работы в Научно-исследовательском физико-химический институте имени Л.Я. Карпова. Фуксом показано, что если U >> kT, то скорость коагуляции близка к нулю и система может рассматриваться как агрегативно устойчивая. Константа скорости k в этом случае определяется соотношением:
k = kБPexp(- U/RT)
или
![]() ,
(6.9)
,
(6.9)
где kБ - константа быстрой коагуляции; P - стерический множитель, учитывающий благоприятные пространственные расположения частиц при их столкновении.
Вероятность слипания частиц выше, если они столкнутся сторонами, гидратированными в меньшей степени. При таком подходе быстрая коагуляция является лишь частным случаем медленной коагуляции, когда выполняется условие, что U = 0 и P = 1. Замедление коагуляции, обусловленное потенциальным барьером отталкивания, характеризуется фактором устойчивости W (коэффициентом стабильности):
![]() (6.10)
(6.10)
