
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
Ионная адсорбция не укладывается в рамки учения о молекулярной адсорбции и требует специального рассмотрения.
Этот вид адсорбции рассматривается только из полярных (водных растворителей) и только на полярных адсорбентах.
При адсорбции ионы поляризуются, заряжая поверхность адсорбента, противоионы (ионы с противоположным знаком) не адсорбируются, но остаются вблизи поверхности с адсорбированными на ней ионами, образуя двойной электрический слой (ДЭС).
Адсорбция ионов зависит от радиуса (r) иона
Из ионов одинакового заряда максимальной способностью к адсорбции обладают ионы наибольшего радиуса (кристаллографического) из-за их меньшей гидратации.
Поясним это:
Молекулы растворенного вещества, растворяясь в воде, распадаются на ионы, которые находятся в гидратированном состоянии.
Рассмотрим ионы первой основной группы (щелочных металлов):
Li+Na+K+



Рис.2.38. Примеры размеров ионов в гидратированном состоянии
Ионы одного заряда, но, естественно, разного ионного (кристаллогарфического) радиуса: у Li+— порядковый номер 4, уNa+ — 23, уK+— 39, но ионы в воде находятся в гидратированном состоянии, окруженными молекулами (диполями) воды — так называемой «гидратной» оболочкой — «гидратной шубой».
Поскольку плотность поверхностного заряда у ионов разная, то и толщина этой оболочки также будет отличаться, причем у иона меньшего радиуса — (Li+) она будет больше, чем у иона большего радиуса, поэтому радиус ионов в гидратированном состоянии обратен их кристаллографическому радиусу.
По возрастающей адсорбционной способности ионы одного заряда можно расположить в так называемые лиотропные ряды. Рассмотрим некоторые из них:
Li+<Na+ <K+ <Rb+ <Cs+Mg+2<Ca+2<Sr+2<Ba+2
В случае анионов, следует учитывать их более сложное строение: ионы могут состоять из нескольких элементов, но и в этом случае гидратированный радиус определяет для ионов одинакового заряда адсорбционную способность ионов.
Рассмотрим ряд однозарядных ионов:
Cl— < Br— < NO3— < J— < CNS—
Адсорбция ионов зависитот заряда:
Чем больше заряд, тем больше адсорбция: K+ << Ca+2 << А l+ 3
В очень сильной степени адсорбционная способность ионов возрастает с увеличением их заряда. Вклад заряда в адсорбционную способность ионов преобладает над влиянием их размера. Так, ионы Ва2+ адсорбируются сильнее, чем ионы Rb+, не смотря на то, что радиус последних больше (1,34A0 и 1,47А0, соответственно).
Правило Панета — Фаянса(**).
Особый интерес представляет адсорбция ионов поверхностью кристалла, в состав которой входят ионы той же природы. При этом адсорбцию можно рассматривать как кристаллизацию, т.е. достройку кристаллической решетки адсорбированными ионами.
Согласно правилу Панета — Фаянса:
Кристаллы достраиваются лишь теми ионами, которые входят в их состав, а также ионами, изоморфными с ионами кристаллической решетки
2.4.6.1.3. Ионно-обменная адсорбция
Адсорбция в растворах-электролитах имеет огромное значение в окружающей нас природе. Именно адсорбция ионов почвой обуславливает её плодородие, а следовательно - и жизнь на Земле.
При адсорбции ионов часто наблюдают так называемую обменную адсорбцию. Она заключается в том, что твёрдый адсорбент поглощает из раствора-электролита катионы или анионы, выделяя одновременно в раствор эквивалентное количество других катионов или анионов.
Сорбенты, способные к обмену ионов, называют ионообменниками или ионитами. Иониты, обменивающиеся с раствором катионами, - катиониты, а обменивающиеся анионами - аниониты.
Амфотерные иониты способны обмениваться как катионами, так и анионами. К катионитам следует отнести алюмосиликаты (цеолиты, пермутиты), силикагель, целлюлозу и т.д.
Примером анионитов могут служить гидроксиды алюминия и железа. Амфотерные иониты способны обменивать и катионы, и анионы. Это синтетические материалы, имеющие состав типа Н+SO3- - R или R – N+(CH3)3OH-, где R – органическая полимерная основа.
И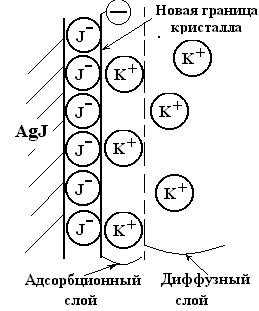 ониты
широко применяются в практической
деятельности, особенно их значение
возросло после 1935 г, когда был осуществлён
промышленный синтез разнообразных
искусственных ионообменников –ионообменных
смол.
ониты
широко применяются в практической
деятельности, особенно их значение
возросло после 1935 г, когда был осуществлён
промышленный синтез разнообразных
искусственных ионообменников –ионообменных
смол.
Ионообменные смолы – это высокомолекулярные нерастворимые в воде соединения, способные набухать, поглощая при этом значительное количество воды. При набухании происходит диссоциации их поверхностных полярных групп и в приповерхностном слое ионита образуется ДЭС.
Ионы ДЭС как раз и обмениваются на другие ионы, имеющие большую адсорбционную способность.
Процесс ионного обмена обратим, и его направление зависит от концентрации обменивающихся ионов. Б.П. Никольский и Е.Н. Гапон(**)для описания закономерностей ионного обмена (1939 г) предложили уравнение:
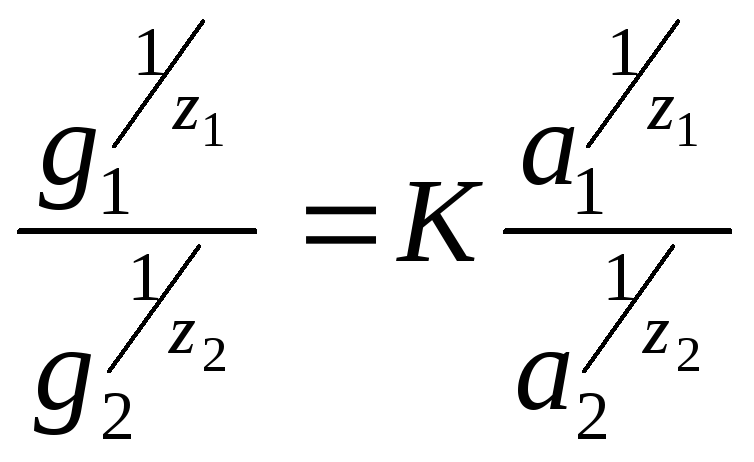 ,
(2.113)
,
(2.113)
где g1иg2– содержание обменивающихся ионов в адсорбенте, моль/г; а1и а2– активности обменивающихся ионов в растворе;z1иz2 – заряд ионов; К – константа. При малых концентрациях растворов-электролитов вместо активностей можно использовать концентрации. В этом случае уравнение Никольского – Гапона для однозарядных ионов имеет вид:
![]() (2.114)
(2.114)
Ионообменная адсорбция на синтетических ионитах часто применяется для деминерализации воды в теплосиловых установках. Довольно широкое распространение она нашла и в пищевых технологиях. Так, в молочной промышленности ионитная обработка молока применяется для получения детского питания, высококачественного легкорастворимого сухого молока и хорошего сгущенного молока (без характерной при избытке кальция “песчаности” и “мутности”). Возможно применение ионитов и для удаления из молока радиоактивных элементов и ионов тяжелых металлов.
Анионитная обработка фруктовых соков позволяет удалять из них кислоты, имеющие неприятный вкус, например яблочную кислоту, и заменить их другими. В производстве лизина микробиологическим путем есть стадия извлечения катионной формы препарата из раствора. Она основана на ионообменной адсорбции:
Обменная адсорбция имеет большое значение для земледелия, так как от природы поглощённых почвой катионов зависит её плодородие. Например, почва способна поглощать и удерживать катионы К+ и NH4+, содержащиеся в удобрениях и необходимые для питания растений. Взамен этих катионов почва выделяет эквивалентные количества других катионов, например Са2+ и Mg2+ Анионы, как, например, С1-, NO3-, SO42-, почти не поглощаются почвой. От природы поглощенных ионов в значительной мере зависят физические и агротехнические свойства почвы.
Иониты широко применяют при получении в производственных условиях деминерализованной воды, т. е. воды, не содержащей растворенных солей (так устраняют жёсткость воды). Для умягчения воды её последовательно пропускают через катионитовый и анионитовый фильтры. Катионит содержит способный к обмену Н+ (Н-форма катионита), анионит – ОН- (ОН - форма анионита).
Рассмотрим в качестве примера удаление NaCI из воды. Катионит, взаимодействуя с хлоридом натрия, обменивает ион натрия на ион водорода, который поступает в раствор:
RH (т) + NaCI (р) RNa (т) + НС1 (р)
Далее воду обрабатывают анионитом в ОН - форме, при этом поглощаются хлорид - ионы:
R'OH (т) + НС1 (р) R'Cl (т) + Н2О,
где RH и R'OH представляют собой иониты, способные к обмену катионов или анионов соответственно.
После использования иониты могут быть регенерированы обработкой раствором серной или соляной кислот (катионит) или растворами гидроксида натрия или гидрокарбоната натрия (анионит).
Большое значение имеют иониты в деле охраны окружающей среды. Так, например, в сточных водах многих производств содержатся ионы тяжелых металлов, которые вредны для живых организмов. Так как концентрация тяжелых металлов в сточных водах очень мала, применение обычных методов очистки (например, осаждения) неэффективно и дорого. Сточные воды пропускают через слой катионита, причем можно использовать катионит, способный обменивать не ионы водорода, а, например, ионы натрия. Ионы тяжелых металлов, обмениваясь на ионы натрия, поглощаются катионитом, из которого их можно извлечь и использовать далее в народном хозяйстве.
