
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
Вклад различных видов энергии в общую энергию притяжения молекул
|
Молекула
|
μˉ 10 30, Кл м |
α 1030, м3 |
Энергия взаимодействия (Е 1067), Дж | ||
|
Еор |
Еинд |
Едисп | |||
|
He
|
0 |
0,203 |
0 |
0 |
1,2 |
|
CO
|
0,33 |
1,926 |
0,0034 |
0,057 |
67,5 |
|
HCl (г) |
3,47
|
1,444 |
18,96 |
5,4 |
105 |
|
H2O (г)
|
6,10 |
1,48 |
190 |
10 |
47 |
|
С6Н6 |
0 |
|
|
|
|
|
С6Н5NО2 |
13,110 |
|
|
|
|
Из приведенных данных видно, что наименьший вклад в межмолекулярное взаимодействие вносят индукционные силы. Для сильно полярных молекул значителен вклад ориентационного взаимодействия (Н2О), С6Н5NО2, а в основном молекулы взаимодействуют за счет дисперсионного взаимодействия.
Наряду с силами притяжения между молекулами возникают и силы отталкивания. Теоретических моделей, описывающих эти силы, нет. Известно, что они действуют на ещё более близких расстояниях, чем силы притяжения. Существует удачное эмпирическое приближение:
![]() (2.5)
(2.5)
Суммарное
выражение для описания сил межмолекулярного
взаимодействия можно выразить, например,
уравнением Леннарда-Джонса(*):![]() (2.6)
(2.6)
На сравнительно далёких расстояниях превалируют силы притяжения, а на малых – силы отталкивания. На определенном расстоянии эти силы должны быть равны, т.к. это отвечает минимуму энергии:
E
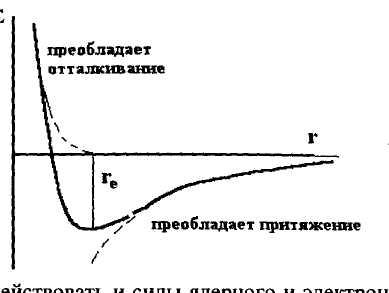
Рис. 2.1. Зависимость потенциальной энергии взаимодействия двух молекул от расстояния между ними
2.2. Поверхностное натяжение
2.2.1. Определения поверхностного натяжения
Возьмем объект такой конфигурации, чтобы при его разрыве плоскостью скольжения образовались две составляющих части с площадью поверхности S. При разрыве тела тратится определенная работа, идущая на разрыв межмолекулярных сил. Естественно, что эта работа пропорциональна площади межфазной поверхности:
W=σ S (2.7)



 +
+
Рис.2.2. К определению поверхностного натяжения как работы образования единицы поверхности
На новой поверхности образуется слой молекул, обладающих большей энергией, чем молекулы внутри фазы. Коэффициент пропорциональности между работой и площадью межфазной поверхности называется коэффициентом поверхностного натяжения или просто поверхностным натяжением.
Исходя из приведенного уравнения, виден физический смысл поверхностного натяжения как работы:
1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
Понятие обратимого процесса накладывает определенное ограничение на использование этого определения, так как не всякую границу раздела фаз можно получить приведёнными рассуждениями обратимо. Например, получение новой площади границы раздела т/г невозможно получить обратимо, т.к. реально нужно учитывать необратимую деформацию молекул. Поэтому часто используют определение поверхностного натяжения как удельной поверхностной энергии.
2. Поверхность раздела фаз обладает избытком нескомпенсированной энергии. Этот избыток в расчете на единицу поверхности составляет удельную свободную поверхностную энергию.
Для увеличения площади жидкой фазы нужно преодолеть внутреннее давление и совершить определенную механическую работу. Если увеличение площади производится при Р, Т = cоnst или V, T = cоnst, то оно сопровождается увеличением поверхностной энергии системы.
Термодинамическое определение поверхностного натяжения вытекает из объединенного уравнения I и II начал термодинамики.
Запишем его для гетерогенной системы относительно внутренней энергии U:dU=TdS–PdV+σdS+∑μidni+φdq(2.8)
при S, V, ni, и q = cоnst dU = σ dS (2.9)
Отсюда
получаем,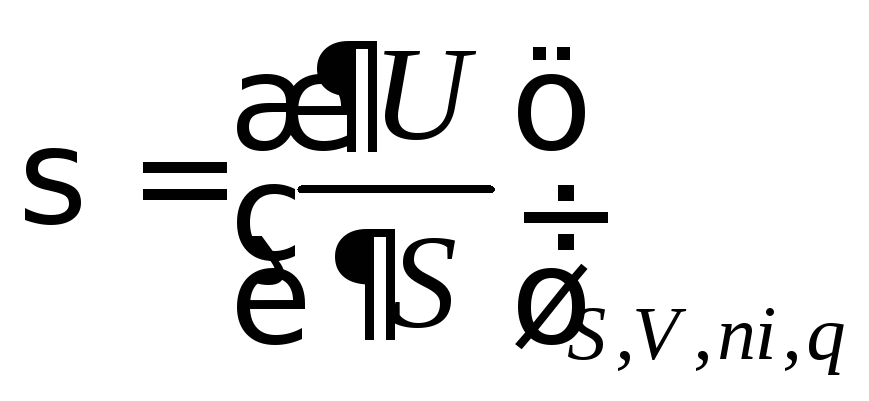 ,
(2.10)
,
(2.10)
т.е. поверхностное натяжение – частная производная от внутренней энергии по площади поверхности раздела фаз при постоянных энтропии, объеме, числе моль вещества и заряде поверхности.
Так как объединенное уравнение может быть записано относительно и других термодинамических потенциалов, то при соответствующих постоянных параметрах получаем:
![]() (2.11)
(2.11)
Поскольку чаще всего мы имеем дело с процессами, происходящими в изобарно-изотермических условиях, то можно встретить такое определение:
Поверхностное натяжение σ – это избыточная удельная поверхностная энергия Гиббса(*).
Для индивидуальных веществ это определение достаточно строгое. Для единицы поверхности можно записать:
σ= Gs (2.12)
«Избыточность» означает, что энергия поверхностных молекул жидкости больше энергии молекул в ее внутреннем объеме.
3) Поверхностное натяжение помимо энергетического (термодинамического) физического смысла имеет и силовой (механический). Это может прояснить простой опыт:
В l С

А D
dx A׳ D ׳
G
Fֿ
Рис.2.3. Рамка Дюпре(*)
На проволочной рамке помещается подвижная перекладина АD длиной l, легко скользящая по рамке. Опускаем рамку в водный раствор мыла. На рамке образуется двухсторонняя мыльная пленка, стягивающая часть рамки длиной l. Приложим к подвижной перекладине АD направленную вниз силу F (груз G). Под действием силы F перекладина АD переместится на бесконечно малое расстояние dx и займет положение А׳ D׳ .
Сила F произведет при этом работу dW=Fdx. (2.13)
Если T=const, то эта работа затрачивается только на увеличение площади пленки: dS = 2l dx (2.14)
dW = σ dS. (2.15)
Определим условие силового механического равновесия перекладины АD при приложении силы F:
dW = F dx = σ dS = σ 2l dx. (2.16)
Такое равновесие обеспечивает сила, направленная в противоположную сторону и равная: σ = F/2l. (2.17)
Поверхностное натяжение количественно равно силе, действующей на единицу длины контура, ограничивающего поверхность жидкости.
Сила поверхностного натяжения направлена тангенциально поверхности раздела фаз и стремится к уменьшению поверхности.
Единицы измерения поверхностного натяжения:
[σ] = Дж/м2 = н *м/ м2 = н/м
2.2.2. Причины возникновения поверхностного натяжения
Рассмотрим действие молекулярных сил на молекулу в глубине и на поверхности жидкости на примере системы ж/г.
Выделим молекулу А в объемной фазе и молекулу Б в поверхностном слое. Силы сцепления, действующие со стороны окружающих молекул на молекулу А, уравновешивают друг друга и их равнодействующая равна 0.
На молекулу Б на поверхности раздела фаз со стороны граничащих фаз действуют силы разного значения. Равнодействующая Р сил молекулы Б направлена перпендикулярно поверхности жидкости. Притяжением со стороны молекул воздуха можно пренебречь и считать, что сила притяжения поверхностных молекул жидкости, занимающих S = 1м2, молекулами глубинных слоев равна внутреннему давлению данной жидкости.
Под внутренним давлением жидкости понимают силу притяжения между молекулами жидкости в ее объеме.
Величина внутреннего давления жидкости велика, например, у полярных приблизительно 108 Па.
Силы притяжения, равные внутреннему давлению, втягивают молекулы жидкости с поверхности в глубь объема, уменьшая площадь поверхности до минимально возможной при данных условиях. Этим объясняется шарообразная форма мелких капель жидкости, находящихся в свободном состояния в аэрозолях, туманах, эмульсиях.
Б

 А
А
Р=0 Р≠0

Рис.2.4. Пояснение к возникновению поверхностного натяжения
Нескомпенсированность сил межмолекулярного взаимодействия ведёт к тому, что молекулы на поверхности энергетически неэквивалентны молекулам внутри фазы, т.е. молекулы на поверхности обладают большей энергией.
ЛЕКЦИЯ 3
