
- •Аннотация
- •От автора
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. СИСТЕМЫ И ПРОЦЕССЫ
- •2. ПОРЯДОК, НЕПОРЯДОК, БЕСПОРЯДОК И ХАОС
- •3. ТЕРМОДИНАМИКА
- •3.1 Начала термодинамики
- •3.2 Равновесная термодинамика
- •4. НЕРАВНОВЕСНАЯ ТЕРМОДИНАМИКА
- •4.1 Диссипативные структуры, системы и среды
- •4.2 Термодинамика необратимых процессов
- •4.3 Линейная неравновесная термодинамика
- •4.4 Нелинейная неравновесная термодинамика
- •4.5 Статистическая термодинамика
- •5. ЭНТРОПИЯ
- •5.1 Определение и свойства энтропии
- •5.2 Энтропия в химической термодинамике
- •5.3 Энтропия в статистической физике
- •5.3.1 Энтропия Больцмана-Планка
- •5.3.2 Энтропия Гиббса
- •5.4 Тсаллис (Цаллис) энтропия (Революция в термодинамике)
- •6. ГЕОМЕТРИЯ ФРАКТАЛОВ
- •6.1 Элементы геометрии фракталов
- •6.2 Размерности фракталов
- •6.3 Примеры фракталов
- •6.4 Фракталы и энтропия
- •7. ИНФОРМАТИКА
- •7.1 Информация, информатика и информационные технологии
- •7.2 Теория информации
- •7.2.1 Информация Хартли
- •7.2.2 Энтропия Шеннона
- •7.3 Отрицательная энтропия, антиэнтропия, экстропия
- •7.4 Алгоритмическая теория информации
- •7.4.1 Энтропия Колмогорова
- •7.4.2 Эпсилон-энтропия
- •7.5 Энтропия Кульбака-Лернера
- •7.6 Энтропия Реньи
- •7.7 Квантовая информатика
- •7.7.1 Некоторые положения квантовой механики
- •7.7.2 Энтропия фон Неймана
- •7.7.3 Линейная энтропия
- •7.7.4 Сравнение энтропий Реньи, Цаллиса и Неймана
- •7.7.5 Энтропия Холево
- •8. СИНЕРГЕТИКА
- •8.1 Синергизм и синергетика
- •8.2 Детерминизм, случайность и неопределённость
- •8.3 Простые и сложные системы
- •8.4 Анализ систем
- •8.5 Параметры порядка (управляющие параметры)
- •8.6 Процессы самоорганизации
- •9. СИСТЕМЫ И ЗАКОНЫ ИХ ЭВОЛЮЦИИ
- •9.1 Статические системы
- •9.2 Динамические системы
- •9.3 Линейные динамические системы
- •9.4 Нелинейные динамические системы
- •9.5 Эволюция динамической системы
- •9.6 Математическое описание эволюции динамической системы
- •10. ОБЫКНОВЕННЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ В ОПИСАНИИ ДИНАМИЧЕСКИХ СИСТЕМ
- •10.1 Обыкновенные дифференциальные уравнения
- •10.2 Фазовое пространство и пространство состояний
- •10.3 Линейные ОДУ на плоскости
- •10.4 Нелинейные дифференциальные уравнения
- •11. ОТОБРАЖЕНИЯ
- •11.1 Системы с дискретным временем в отображениях
- •11.2 Итерации в исследовании динамических систем
- •11.3 Графические методы нахождения неподвижных точек и исследования их свойств
- •11.4 Многопараметрические отображения
- •11.5 Примеры некоторых важные отображений
- •12. ОСОБЫЕ ТОЧКИ ФАЗОВЫХ ПОРТРЕТОВ ДИНАМИЧЕСКИХ СИСТЕМ
- •12.1 Дифференциальные уравнения и особые точки
- •12.2 Классификация точек равновесия
- •12.3 Фазовые портреты и особые точки нелинейных ОДУ
- •12.4 Многомерные системы
- •13. РЕГУЛЯРНЫЕ АТТРАКТОРЫ И РЕПЕЛЛЕРЫ
- •13.1 Типы аттракторов
- •13.2 Фазовый объём
- •13.3 Репеллеры
- •13.4 Осциллятор и осцилляции
- •14. УСТОЙЧИВОСТЬ ДИНАМИЧЕСКИХ СИСТЕМ
- •14.1 Устойчивые и неустойчивые равновесия
- •14.2 Устойчивость по Ляпунову (метод первого приближения)
- •14.3 Показатель Ляпунова
- •14.4 Устойчивость нелинейной системы
- •14.5 Метод функций Ляпунова
- •14.6 Функция Ляпунова и энтропия
- •14.7 Асимптотическая устойчивость
- •14.8 Устойчивость особых точек
- •14.9 Устойчивость особых точек
- •14.10 Устойчивость решений дискретных уравнений
- •15. БИФУРКАЦИИ
- •15.1 Бифуркации: основные понятия и классификация
- •15.2 Элементы теории бифуркаций
- •15.3 Простейшие бифуркации
- •16. БИФУРКАЦИИ ЦИКЛОВ
- •16.1 Предельные циклы
- •16.2 Устойчивость предельных циклов
- •16.3 Бифуркации устойчивых предельных циклов
- •16.5 Бифуркация рождения пары устойчивых замкнутых траекторий.
- •16.6 Транскритическая (обмена устойчивостью между циклами) бифуркация.
- •16.7 Бифуркация исчезновения (рождения) пары замкнутых траекторий.
- •16.8 Бифуркация удвоения периода цикла
- •16.9 Бифуркация рождения (гибели) двумерного тора.
- •16.10 Гомоклиническая бифуркация рождения/исчезновения цикла
- •17. ДИНАМИЧЕСКИЙ ХАОС
- •17.1 Хаос статистический и динамический
- •17.2 Предсказание статического поведения системы
- •17.3 Сценарии перехода к хаосу
- •17.4 Примеры систем с хаосом
- •18. ХАОС В ЛИНЕЙНЫХ ОДНОМЕРНЫХ СИСТЕМАХ
- •18.1 Бифуркационные диаграммы
- •18.2 Лестница Ламерея
- •18.3 Отображение Бернулли
- •18.4 Треугольное отображение
- •18.5 Отображение «тент»
- •18.6 Канторов репеллер
- •18.7 Детерминированная диффузия
- •19. ХАОС В ЛОГИСТИЧЕСКОМ ОТОБРАЖЕНИИ
- •19.1 Переход к хаосу через удвоение периода
- •19.2 Логистическое уравнение
- •19.3 Дискретное логистическое уравнение
- •19.4 Логистическое отображение
- •19.5 Бифуркационная диаграмма логистического отображения
- •19.6 Цикл периода 3
- •19.7 Фазовые диаграммы логистического отображения
- •19.8 Аттракторы и фракталы в логистическом отображении
- •20. ХАОС В НЕЛИНЕЙНЫХ ОДНОМЕРНЫХ ОТОБРАЖЕНИЯХ
- •20.1 Отображение xn+1=С+xn2.
- •20.2 Отображение xn+1=а-xn2.
- •20.3 Подобие окон периодической динамики
- •20.4 Порядок Шарковского
- •20.5 Универсальность Фейгенбаума
- •20.6 Устойчивость циклов одномерных отображений
- •20.7 Топологическая энтропия
- •20.8 Синус-отображение
- •21. ХАОС В НЕЛИНЕЙНЫХ ДВУМЕРНЫХ ОТОБРАЖЕНИЯХ
- •21.1 Отображение Эно (Henon map)
- •21.2 Отображение подковы и отображение пекаря
- •21.3 Отображение «кот Арнольда» (Arnold’s cat map)
- •22. НЕРЕГУЛЯРНЫЕ АТТРАКТОРЫ
- •22.1 Хаос в консервативных и диссипативных системах
- •22.2 Регулярные и хаотические аттракторы
- •22.3 Квазиаттракторы
- •22.4 Хаотически аттракторы
- •22.5 Негиперболические хаотические аттракторы
- •22.6 Фрактальные аттракторы
- •22.7 Характеристика нерегулярных аттракторов
- •22.8 Странные нехаотические аттракторы
- •22.9 Сингулярные аттракторы
- •22.10 Многомерные нерегулярные аттракторы
- •22.11 Дикие аттракторы

http://profbeckman.narod.ru/
Статистическая физика рассматривает энтропию как меру вероятности пребывания системы в данном состоянии (принцип Больцмана). Здесь энтропия выражает неопределенность микроскопического состояния системы: чем больше микроскопических состояний системы соответствуют данному макроскопическому состоянию, тем выше термодинамическая вероятность и энтропии последнего. Система с маловероятной структурой, предоставленная самой себе, развивается в сторону наиболее вероятной структуры, т.е. в сторону возрастания энтропии. Это, однако, относится только к замкнутым системам. Энтропия – функция состояния, т. е. не зависит от способа достижения этого состояния, а определяется параметрами этого состояния. Так как W может быть только натуральным числом (1, 2, 3, …), то энтропия Больцмана должна быть неотрицательной (свойство логарифма).
Статистика Больцмана обладает существенными недостатками: различимость частиц, использование формулы Стирлинга, невозможность применения к системам со взаимодействующими частицами.
5.3.2 Энтропия Гиббса
Равновесное состояние системы с функцией Гамильтона Н(X) характеризуется каноническим распределением Гиббса
f0 |
X exp |
F0 H(X ) |
, |
f0dX 1. |
(52) |
|
|||||
|
|
kT |
|
|
|
Пусть f(X, t) – произвольное распределение с той же нормировкой, но с одним ограничением: среднее значение функции Гамильтона для распределений f0, f одинаково,
т. е. Hf0 X Hf X ,t dX .
Через S0, S обозначим энтропии, отвечающие распределениям f0, f. Тогда согласно теореме Гиббса
f
S0 S k ln f0 fdX 0.
Таким образом, при условии постоянства средней энергии энтропия в состоянии равновесия максимальна. Здесь нет ограничений па взаимодействие частиц системы. В этом отношении результат Гиббса является более общим, чем Н-теорема. Здесь, однако, не рассматривается вопрос о временной эволюции функции при релаксации к равновесному состоянию.
В статистической термодинамике формулу энтропии Гиббса записывают а виде
S kB pi ln pi |
(53) |
i |
|
Эта формула используется для вычисления статистической механической энтропии термодинамической системы; суммирование ведётся по всем возможным состояниям системы (обычно по 6N-мерным точкам, если система состоит из N частиц); множитель kB отражает два факта: выбор основания логарифма и выбор температурной шкалы.
Энтропия Гиббса имеет более общий характер, чем энтропия Больцмана. При пренебрежении корреляциями между частицами теория Гиббса упрощается до теории Больцмана.
В каком-то смысле, энтропию можно рассматривать как на меру беспорядка в системе (энтропия, как стремление к хаосу). Это обусловлено тем, что «упорядоченными» системами считаются системы, имеющие очень малую возможность конфигурирования, тогда как «беспорядочные» системы имеют очень много возможных состояний. Поэтому энтропия – число микросостояний на данное макросостояние. Например, в случае идеального газа наиболее вероятным состоянием, соответствующим максимуму энтропии, естьт равномерное распределение молекул. При этом реализуется и максимальный «беспорядок», так как реализуются максимальные возможности конфигурирования. Всё же энтропия не столько мера беспорядка, а сколько мера вероятности протекания
http://profbeckman.narod.ru/
самопроизвольного процесса в изолированной термодинамической системе. Процесс же наиболее вероятен тогда, когда все молекулы вещества, или элементы системы занимают или займут в результате процесса равное (одинаковое) энергетическое состояние, при этом станет невозможен никакой дальнейший процесс (система термодинамически устойчива).
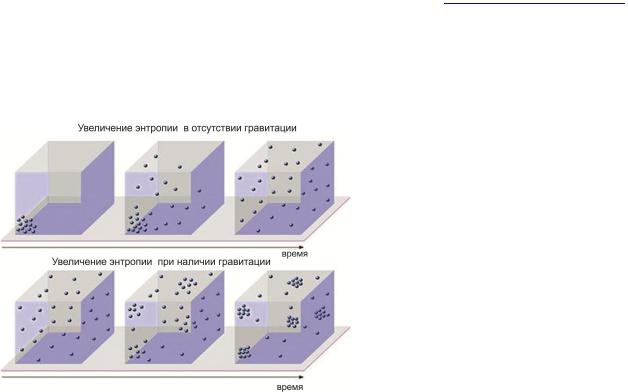
Рис. 4. Степень «беспорядка» в замкнутой системе (энтропия) может со временем только возрастать (2-й закон термодинамики). При впуске газа в некоторый объём, его молекулы равномерно распределяются по всему пространству – наступает термодинамическое равновесие, при котором энтропия максимальна (верхний рисунок). В больших системах с мощной гравитацией (пример – Вселенная), сила тяжести приводит к образованию скопление в первоначально почти однородном распределении газа (нижний рисунок).
Так образуются звезды и галактики.
Такое состояние не всегда совпадает с наибольшим беспорядком (хаосом) и напротив хаос сам по себе не является устойчивым состоянием: он несёт потенцию – либо достижения ещё большего хаоса либо увеличения энтальпии то есть порядка в системе. В неизолированных (закрытых), а тем более открытых системах понятие энтропии несколько условно. Это функция, зависящая от краевых начальных и граничных условий, без которых, эта функция – есть фикция. Энтропия – мера экстенсивности термодинамической системы: при данном интенсивном факторе, которым выступает температура, произведение энтропии на изменение температуры и есть изменение энергии системы. Энтропия может и не меняться, тогда как энергия системы изменяться будет. При изотермических процессах составляющая энергии системы, в которую входит энтропия, равна нолю.
Энтропия характеризует структуру системы с точки зрения распределения энергии в объёме внутри и вокруг системы, отражая меру связи и взаимодействия частиц системы. Она пропорциональна отношению упорядоченной (структурной, потенциальной) энергии, обеспечивающей целостность и неизменность системы, к хаотической энергии теплового движения частиц. Упорядоченная энергия – энергия направленного движения вещества, энергия сжатия от давления и потенциальная энергия вещества в гравитационном и электромагнитных полях. Под необратимыми подразумеваются процессы, сопровождающиеся возрастанием энтропии всей замкнутой системы. Процессы, которые были бы их повторениями в обратном порядке – не могут происходить, так как при этом энтропия должна была бы уменьшиться. Обратимыми же называют процессы, при которых термодинамическая энтропия замкнутой системы остается постоянной. (Энтропия отдельных частей системы при этом не обязательно будет постоянной.)
Применение понятия термодинамической энтропии совершенно неправомерно в двух случаях:
–когда смешивают различные понимания беспорядка, и энтропия становится мерой беспорядка вообще;
–когда понятие энтропии применяется для систем, не являющихся термодинамическими.

http://profbeckman.narod.ru/
Например при кристаллизации переохлаждённой жидкости образование структур из «хаотичной» жидкости (увеличение порядка) идёт параллельно с увеличением энтропии (ростом беспорядка).
Замечание. Из вероятностной трактовки энтропии в статистической физике выводятся основные равновесные распределения: каноническое распределение Гиббса, которое соответствует максимальному значению информационной энтропии при заданной средней энергии, и большое каноническое распределение Гиббса – при заданных средней энергии и среднем числе частиц в системе.
Энтропия Гиббса – аддитивная безразмерная величина:
SG (t) Wn t lnWn t . |
(54) |
n |
|
Из неравенства 0Wn(t)1 следует, что SG(t)0. Только в частном случае, когда статистический оператор описывает чистое квантовое состояние, мы имеем SG(t)=0. Вероятность состояния W равна отношению числа микросостояний K, благоприятных данному макросостоянию, к полному числу возможных микросостояний L: W = K/L.
Величину W можно принять за меру беспорядка в системе, если принять, что упорядоченная система имеет малую возможность конфигурирования, тогда как беспорядочная система имеет много возможных состояний. Так, в случае идеального газа наиболее вероятным состоянием, соответствующим максимуму энтропии, будет равномерное распределение молекул. При этом реализуется и максимальный «беспорядок», так как при этом будут максимальные возможности конфигурирования.
Тут надо быть осторожным: энтропия приложима лишь к конкретной системе и конкретной ситуации. Беспорядок вообще она не рассматривает.
Например, в поле тяготения наиболее вероятным является распределение молекул, описываемое барометрической формулой Больцмана, а вовсе не равномерное распределение. При наличии электромагнитных сил взаимодействия между ионами наиболее вероятным состоянием, соответствующим максимуму энтропии, будет упорядоченное кристаллическое состояние, а совсем не «хаос». При кристаллизации переохлаждённой жидкости образование структур из «хаотичной» жидкости идёт параллельно с увеличением энтропии.
Пример. Имеем набор 10 монет, каждая из которых может находиться либо в состоянии «орёл», либо в состоянии «решка». Наиболее «упорядоченным» макроскопическим состоянием будет являться или 10 «орлов», или 10 «решек»; для каждого результата в каждом случае имеется только одна возможная конфигурация. И наоборот, наиболее «неупорядоченное» состояние содержит 5 «орлов» и 5 «решек», и здесь 10С5=252 способов для получения этого результата. Этот пример некорректен, так как система монет не является термодинамической системой, и поэтому термодинамическая энтропия системы в обоих случаях (как бы ни были перевёрнуты монеты) окажется, конечно, одинаковой. Так, разбросанные по комнате стулья не имеют отношения к термодинамической энтропии, хотя и могут иметь отношение к энтропии информационной. Важно, что замкнутая система 10 монет, перевёрнутых орлами вверх, самопроизвольно не перейдёт в систему хаотично перевёрнутых монет.
В настоящее время полагают, что dQ/T=klnW. Однако до сих пор никто не доказал это равенство, более то до сих не удалось по статистической энтропии найти термодинамическую энтропию. Между тем можно упомянуть несколько отличий Sterm от Sstat. В термодинамике энтропия является носителем тепловой формы движения, т.е. величиной, способной передаваться через границы системы в процессе теплообмена или массообмена между ней и окружающей средой. В термодинамике неравновесных процессов используется понятие "потока энтропии", аналогичного потоку вещества, заряда и т.п. Говорить же о переносе через границы системы "вероятности состояния" бессмысленно. Далее, статистическая энтропия может убывать в процессах "самоорганизации" по мере удаления от состояния равновесия, в то время как термодинамическая энтропия остается при этом неизменной. Процесс смешения невзаимодействующих газов при постоянном объеме после удаления разделявшей их

http://profbeckman.narod.ru/
перегородки не изменяет ни температуры, ни давления, ни состава системы в целом. Многокомпонентная система еще до смешения находится в полном (термическом, механическом и химическом) равновесии, так что процесс смешения не вызывает приближения ее к равновесию ни по одной из располагаемых ею степеней свободы. Тем не менее, процесс самопроизвольного перемешивания также соответствует приближению системы к более вероятному состоянию. Эта тенденция к перемешиванию возникает уже при числе молекул, равном или большем трех при сколь угодно малом взаимодействии между ними, т.е. в условиях, когда совершенно неуместно говорить вообще о термодинамической системе.
Модель Больцмана может быть применена только к идеальному газу (система невзаимодействующих частиц). Недостатки статистики Больцмана: различимость частиц, использование формулы Стирлинга, невозможность применения к системам со взаимодействующими частицами. Более продвинутыми являются статистика БозеЭйнштейна и статистика Ферми-Дирака, в которых частицы неразличимы.
Вернёмся к проблеме оценки степени порядка/беспорядка по энтропии.
В качестве примера рассмотрим плавление льда. Легко показать что изменение энтропии при плавлении льда Sплав=Sжид - Sтвёрд = Qплав/Т= 1434/273=5,27 кал/(моль.К).
Считается, что при плавлении порядок уменьшается, можно сравнить с плавлением поваренной соли, или, скажем, железа. Но это всё! Собственно как развивался процесс в пространстве и времени (начиналось ли таяние с поверхности льда, или центры плавления статистически возникали по всему объёму, какую роль играли трещины, раскалывался ли брусок на отдельные куски и т.д.) ничего сказать нельзя. Тем более бесполезно говорить о смене порядка при плавлении снежинок: формы их различны, плавление их осуществляется различно, но изменение энтропии всегда будет одним и тем же. Знание
энтропии ничего не может сказать о порядке исходных и конечных структур и об особенностях перехода одной структуры в другую.
Рис. 5. Изменение энтропии воды при плавлении льда и испарении воды. Можно следить за изменение величины порядка в системе, определить температуры переходов и оценить величину скачкообразного роста беспорядка. Что это был за упорядоченный хаос и как он менялся в пространтве-времени ничего сказать нельзя.
Кристаллические и аморфные тела сильно отличаются друг от друга по величине энтропии в смысле Больцмана-Планка, но совершенно одинаковы с точки зрения термодинамической энтропии. Совершенно разные структуры имеют одинаковую энтропию, поэтому прямую задачу – нахождение энтропии по структуре решить иногда можно (по крайней мере для объектов простой геометрии), но обратная задача – нахождение структуры (порядка) по энтропии не решаема.
В природе существуют энтропийно идентичные, но структурно разные объекты.

http://profbeckman.narod.ru/
Рис. 6. Узоры льда на стекле - борьба порядка с беспорядком. Термодинамическая энтропия равна энтропии плавления куска льда, а энтропия Больцмана-Планка намного больше (только до сих её никто почему-то не посчитал).
Рис. 7. Формы снежинок: форма их разная, термодинамическая энтропия одинакова, а статистическая энтропия различна.
