
- •Ющенко ю.С.
- •Чернівці Зелена Буковина 2005
- •Наука про природні води
- •Предмет і об’єкт гідрологічних досліджень
- •1.1.1. Уявлення про природні води до Нового часу
- •1.1.2. Формування основ наукової гідрології
- •1.1.3. Сучасна гідрологія
- •1.1.4. Природні води — об’єкт дослідження гідрології
- •1.1.5. Різноманітність водних об’єктів Землі
- •1.1.6. Колообіги та циркуляції природних вод
- •Середньорічний водний баланс Землі [12]
- •1.1.7. Зміни водних об’єктів в часі
- •1.1.8. Основні гідрологічні поняття та терміни
- •Фундаментальні основи гідрологічних досліджень
- •1.2.1. Молекули та надмолекулярні структури води
- •1.2.2. Агрегатні стани та фазові переходи води
- •1.2.3. Густина води
- •1.2.4. Теплові властивості води
- •1.2.5. В’язкість, поверхневий натяг та змочування
- •1.2.6. Деякі фізичні властивості снігу та льоду
- •1.2.7. Умови перебування води в ґрунтах та породах
- •1.2.8. Механіка рідини і дослідження природних вод
- •1.2.9. Основи статики природних вод
- •1.2.10. Загальні поняття та визначення гідродинаміки
- •1.2.11. Види руху водних потоків
- •1.2.12. Два режими руху рідини
- •1.2.13. Рівняння нерозривності
- •1.2.14. Рівняння Бернуллі
- •1.2.15. Рух поверхневих водотоків
- •1.2.16. Спокійні та бурхливі потоки
- •1.2.17. Приклади ламінарного руху
- •1.2.18 Течії у водойомах
- •1.2.19. Хвилі у воді
- •1.2.20. Стратифікація, стійкість та перемішування природних вод
- •1.2.21. Природні води як хімічний розчин
- •1.2.22. Основні типи домішок у природних водах
- •Головні іони в океанічних водах (за с. Бруєвичем)
- •1.2.23 Гідрохімічна класифікація природних вод. Зміни їх складу
- •1.2.24. Забруднення та якість природних вод
- •Методи гідрологічних досліджень
- •1.3.1. Математичні методи, інформатика
- •1.3.2. Системний підхід
- •1.3.3. Експеримент та моделювання
- •1.3.4. Порівняння, типізація, класифікація
- •1.3.5. Історичний метод
- •1.3.6. Прогнозування
- •1.3.7. Експедиційний метод
- •1.3.8. Вимірювання, спостереження, моніторинг
- •1.3.9. Балансові методи
- •1.3.10. Картографічні методи
- •1.3.11. Географо-гідрологічні методи
- •1.3.12. Еколого-гідрологічні методи
- •Гідрологія водних об’єктів
- •Гідрологія океанів і морів
- •2.1.1. Поділ Світового океану
- •Основні характеристики океанів
- •2.1.2. Рельєф дна та донні відклади Світового океану
- •2.1.3. Розподіл основних гідрологічних характеристик та водні маси океану. Процеси перемішування
- •2.1.4 Морський лід
- •2.1.5. Морські хвилі
- •2.1.6. Припливи в океані
- •2.1.7. Морські течії
- •2.1.8. Рівень океанів і морів
- •2.1.9. Життя в океані
- •2.1.10. Моря України
- •Гідрологія льодовиків
- •2.2.1. Процеси утворення льодовиків
- •2.2.2. Рух льодовиків
- •2.2.3. Розповсюдження, основні типи, будова та гідрографічна сітка льодовиків
- •2.2.4. Баланс та режим льодовиків
- •2.2.5. Процеси та явища пов’язані з льодовиками
- •Гідрологія підземних вод
- •2.3.1. Походження підземних вод
- •2.3.2. Класифікації підземних вод
- •2.3.3. Води зони аерації
- •2.3.4. Ґрунтові води
- •2.3.5. Артезіанські води
- •2.3.6. Підземні води у тріщинуватих та закарстованих породах
- •2.3.7. Структури підземної гідросфери
- •2.3.8. Рух підземних вод
- •2.3.9. Підземний стік
- •2.3.10. Природні явища та процеси пов’язані з підземними водами
- •Гідрологія річок
- •Найбільші річки світу
- •2.4.1. Річкові системи
- •2.4.2. Річкові водозбори
- •2.4.3. Річкові долини
- •2.4.4. Русла та заплави річок
- •2.4.5. Рух води в річках
- •2.4.6. Поняття про водний режим річок
- •2.4.7. Процеси водного живлення річок
- •2.4.8. Аналіз водного режиму річок
- •2.4.9. Рівневий режим річок
- •2.4.10. Утворення та основні характеристики річкових наносів
- •2.4.11. Основні категорії та стік наносів
- •2.4.12. Поняття про русловий процес річок
- •2.4.13. Типізації та класифікації руслового процесу
- •2.4.14. Термічний режим річок
- •2.4.15. Льодовий режим річок
- •2.4.16. Гідрохімічний режим та особливості гідробіології річок
- •Гідрологія озер
- •Найбільші озера світу
- •2.5.1. Котловини озер
- •2.5.2. Морфометрія та морфологія озер
- •2.5.3. Термічний режим озер
- •2.5.4. Льодовий режим озер
- •2.5.5. Динаміка озер
- •2.5.6. Водний режим озер
- •2.5.7. Гідрохімічні та гідробіологічні особливості озер
- •2.5.8. Донні відклади озер
- •Гідрологія особливих типів водних об’єктів
- •2.6.1. Сніговий покрив
- •2.6.2. Гідрологічні явища та процеси в зоні багаторічної мерзлоти та холодного клімату
- •2.6.4. Гідрологія водосховищ
- •2.6.5. Канали та гідромеліоративні системи
- •2.6.6. Гідрологія боліт
- •2.6.7. Гідрологія гирл річок
- •Типи гирлових областей річок
- •Загальні гідрологічні явища та процеси
- •Природні води і атмосфера Землі
- •3.1.1. Кліматична система Землі і природні води
- •Характеристики складових кліматичної системи Землі
- •3.1.2. Взаємодія океану та атмосфери
- •3.1.3. Атмосферна ланка колообігу води
- •Водний баланс та стік води з суходолу
- •3.2.1. Водний баланс територій
- •3.2.2. Формування стоку
- •3.2.3. Стік води в річках
- •Природні води і тверде тіло Землі
- •3.3.1. Літосфера та підземні води
- •3.2.2. Ендогенний вплив на поверхневу гідросферу
- •3.3.3. Природні води і рельєф
- •3.3.4. Гідрогенні відклади та акумулятивні утворення
- •Природні води та еволюційні процеси
- •3.4.1. Еволюція географічної оболонки та її складових
- •3.4.2. Біогенний етап розвитку природних вод
- •3.4.3. Антропогенний етап розвитку природних вод
- •Заключення Новітній етап розвитку гідрології
1.2.21. Природні води як хімічний розчин
Вода у природі завжди вміщує певні домішки. Частина з них є розчиненими речовинами. Їх концентрації якправило невеликі. Тому природні води являють собою слабкий розчин. Він може бути як справжнім, так і колоїдним. Точніше він поєднує ці різновиди, це складний комплекс речовин. Вода дуже добрий розчинник. В природних водах, у першу чергу морських, зафіксовані практично всі хімічні елементи Землі. Властивості води як розчинника тісно пов’язані з особливостями будови її молекули (електричний диполь). Крім колоїдів у природних водах зустрічаються суспензії та зважені частки (зависі). Вони є основою утворення донних відкладів водойм, змінюють деякі властивості води. Крупність цих часток така, що окремі можна бачити оком.
Процеси утворення та змін розчинів пов’язані з такими властивостями речовин як розчинність та дисоціація. Під розчинністю розуміють здатність речовин утворювати з водою однорідну систему, тобто таку, що характеризується новими загальними властивостями. Наприклад: між твердим тілом та розчином відбувається обмін іонами, або молекулами. Швидкість розчинення залежить від температури та тиску, а швидкість осадження від температури та концепції розчиненої речовини.
Дисоціація, тобто роз’єднання молекул на іони, найбільш характерна для розчинів електролітів. Але чиста вода також характеризується наявністю процесу дисоціації. Його описують рівнянням:
![]()
Швидкості
дисоціації та утворення молекул в
діапазоні температур від 0° С до 50° С
приблизно рівні і дуже малі, а добуток
концентрацій іонів є постійною величиною
![]() .
Оскільки концентрації
.
Оскільки концентрації
![]() та
та
![]() рівні,
то для кожного вони складають
рівні,
то для кожного вони складають
![]() .
Показник вмісту іону прийнято називати
водневим показником, і виражати так:
.
Показник вмісту іону прийнято називати
водневим показником, і виражати так:
![]() .
.
Одиниці
вимірювання при цьому не записуються.
Величина
![]() означає нейтральну реакцію, або стан
розчину. При
означає нейтральну реакцію, або стан
розчину. При
![]() реакція
кисла (концентрація іонів
більша),
а при
реакція
кисла (концентрація іонів
більша),
а при
![]() — лужна. Водневий показник в різних
умовах залежить від характеристик
домішок у воді, а також від термодинамічних
характеристик.
— лужна. Водневий показник в різних
умовах залежить від характеристик
домішок у воді, а також від термодинамічних
характеристик.
Він відіграє значну роль у визначенні якості води. В річкових водах його значення змінюються від 6,5 до 8,5; атмосферних опадах — від 4,6 до 6,0; в океані — від 7,9 до 8,3; в болотах — від 5,5 до 6,0. У водах копалень та рудників він може досягати 1,0; а содових (карбонатних) озер — 10,0. Водневий показник може змінюватися по порах року. Наприклад для більшості річок він взимку складає 6,8-7,4; а влітку — 7,4-8,2.
У
більшості природних вод серед домішок
переважають мінеральні речовини і у
першу чергу розчинені солі. Тому основними
показниками природних розчинів є
мінералізація, або солоність. Перший
термін частіше використовують для вод
суходолу і визначають як сумарний вміст
усіх знайдених при хімічному аналізі
мінеральних речовин
![]() .
Термін «солоність» використовують у
дослідженнях морських вод. Це сумарний
вміст усіх твердих мінеральних розчинених
речовин в 1 кг морської води при умові,
що всі тверді речовини висушені до
постійної маси при температурі 480°С,
органічні речовини повністю спалені,
броміди та йодіди замінені еквівалентною
масою хлориду, а усі вуглекислі солі
переведені в оксиди. Вона виражається
у проміле
.
Термін «солоність» використовують у
дослідженнях морських вод. Це сумарний
вміст усіх твердих мінеральних розчинених
речовин в 1 кг морської води при умові,
що всі тверді речовини висушені до
постійної маси при температурі 480°С,
органічні речовини повністю спалені,
броміди та йодіди замінені еквівалентною
масою хлориду, а усі вуглекислі солі
переведені в оксиди. Вона виражається
у проміле
![]() .
Завдяки тривалій історії розвитку
сольової маси океанукількісні
співвідношення між концентраціями
головних іонів (сольовий склад морських
вод) зберігаються однаковими незалежно
від їх абсолютної концентрації. Наприклад
мають місце такі співвідношення:
.
Завдяки тривалій історії розвитку
сольової маси океанукількісні
співвідношення між концентраціями
головних іонів (сольовий склад морських
вод) зберігаються однаковими незалежно
від їх абсолютної концентрації. Наприклад
мають місце такі співвідношення:
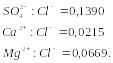
Відхилення від цієї закономірності спостерігаються лише у районах сильного впливу прісних річкових вод, та у деяких внутрішніх морях.
Мінералізація
та солоність вод змінюються у значних
межах — від
![]() в атмосферних опадах до
в атмосферних опадах до
![]() в деяких видах ропи (розсолу). Таким
чином не всякі природні води є лише
слабким розчином. Їх поділяють на чотири
групи.
в деяких видах ропи (розсолу). Таким
чином не всякі природні води є лише
слабким розчином. Їх поділяють на чотири
групи.
1.
![]() Це
прісні води, які є питтєвими.
Це
прісні води, які є питтєвими.
2.
![]() Солонуваті.
При S
= 24,7‰ температура
найбільшої густини та замерзання води
співпадають.
Солонуваті.
При S
= 24,7‰ температура
найбільшої густини та замерзання води
співпадають.
3.
![]() Солоні,
морської солоності.
Солоні,
морської солоності.
![]() у
морях практично не спостерігається.
у
морях практично не спостерігається.
4.
![]() Сильносолоні
(розсоли).
Сильносолоні
(розсоли).
Особливим
поняттям є «мінеральні води». Це в
основному підземні води, що характеризуються
наявністю деяких біологічно активних
компонентів (![]() та ін.). Часто вони мають підвищену
температуру та радіоактивність. Межею
з прісною водою вважають
та ін.). Часто вони мають підвищену
температуру та радіоактивність. Межею
з прісною водою вважають
![]() .
Мінеральні води розрізняють (класифікують)
за мінералізацією, іонним складом,
газовим складом та специфічними
елементами. Межі груп (назви), звичайно,
дещо умовні.
.
Мінеральні води розрізняють (класифікують)
за мінералізацією, іонним складом,
газовим складом та специфічними
елементами. Межі груп (назви), звичайно,
дещо умовні.
Мінералізація та склад природних вод впливають на їх властивості та процеси, що в них відбуваються. До важливих властивостей відносяться жорсткість (твердість), агресивність, лужність та інші.
Твердість
води пов’язана з присутністю розчинених
солей кальцію та магнію. Розрізняють
кальцієву, магнієву та загальну
(карбонатну та не карбонатну) твердість.
При кип’ятінні вона зменшується і
досягає постійної величини. Вода з
твердістю менше
![]() характеризується як м’яка, від 4 до
характеризується як м’яка, від 4 до
![]() —
середньої твердості, від 8 до
—
середньої твердості, від 8 до
![]() —
тверда, більше
— дуже тверда. Тверда вода не придатна
до пиття, а дуже тверда навіть для
технічних потреб (на металах з’являються
шкідливі накипи та відклади).
—
тверда, більше
— дуже тверда. Тверда вода не придатна
до пиття, а дуже тверда навіть для
технічних потреб (на металах з’являються
шкідливі накипи та відклади).
Під агресивністю розуміють здатність природних водних розчинів руйнувати шляхом хімічної дії різні матеріали (бетон, конструкції з вапняків, метали). Під впливом скидання у водні об’єкти промислових, побутових та інших стічних вод, особливо таких, що містять соляну, сірчану, інші кислоти та солі амонію, агресивність природної води може значно посилитися. Розрізняють вилуговуючу, магнезіальну, загально-кислотну, сульфатну та вуглекислу агресивність.
Важливою характеристикою поверхневих та морських вод є їх лужність. За нею можна судити про гідрохімічні та геохімічні процеси: формування хімічного складу води, утворення осадових (зокрема карбонантних) порід та інші. Лужність пов’язана з наявністю аніонів слабких кислот, головним чином вугільної (карбонової). Гідроліз аніонів приводить до утворення гідроксильних іонів:
![]() (1.171)
(1.171)
![]() (1.172)
(1.172)
Лужність проявляється також в деяких видах підземних вод. Вона впливає на формування якості води.
Хімічні речовини та елементи в природних водах, біосфері, інших геосферах знаходяться в русі — мігрують. Це відбувається шляхом механічного руху водних мас, випадання в осад, видалення в атмосферу, споживання живими організмами та ін. Можливості переміщень називають міграційною здатністю. Розрізняють внутрішні та зовнішні фактори міграції. До внутрішніх відносять: валентність, іонні радіуси, іонні потенціали. До зовнішніх — енергетику Землі (температурні умови, потоки енергії), склад атмосфери, клімат, біогенні умови.
Різноманітність природних та антропогенно змінених водних розчинів і процесів у них надзвичайно велика. Їх вивчають гідрохімія, гідрогеохімія, прикладна екологія та інші науки. Вони впливають на розвиток природних та технічних систем, на формування водних ресурсів.
