
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
10.9. Влияние электролитов на двойной электрический слой.
По
влиянию на двойной электрический слой
все электролиты делятся на две группы:
индифферентные
и неиндифферентные.
Индифферентными
называются электролиты, не содержащие
потенциал - определяющих ионов.
Эти электролиты не
способны достраивать кристаллическую
решетку, адсорбироваться на поверхности
и изменять величину потенциала поверхности
.
Например, для золя
,
стабилизированного
![]() ,
мицелла которого имеет формулу
,
мицелла которого имеет формулу
![]() индифферентными являются такие
электролиты, как
индифферентными являются такие
электролиты, как
![]() ,
,
![]() ,
,
а
,
,
а
![]() не является индифферентным электролитом,
так как
не является индифферентным электролитом,
так как
![]() изоморфен
изоморфен
![]() и способен достраивать кристаллическую
решетку.
и способен достраивать кристаллическую
решетку.
Преимущественное влияние на ДЭС оказывает ион электролита, имеющий заряд, одинаковый с зарядом противоиона частицы. При добавлении электролита в адсорбционный слой втягивается больше противоионов, и компенсация заряда поверхности достигается в слое меньшей толщины. Одновременно происходит сжатие диффузной части ДЭС. Вместе с противоионами в ДЭС вводятся другие сопутствующие ионы, которые имеют такой же заряд, что и потенциалопределяющие ионы, то есть одинаковый с зарядом поверхности. Поэтому сопутствующие ионы мало влияют на ДЭС.
10.10. Влияние концентрации электролита.
Влияние концентрации электролита на ДЭС показано на рисунке рис. 10.12.
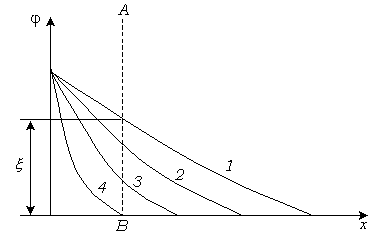
Рис. 10.12. Влияние концентрации электролита на ДЭС.
Концентрация
электролита увеличивается в ряду:
1-2-3-4. Происходит сжатие ДЭС и уменьшение
-потенциала.
При полной компенсации заряда поверхности
![]() и возникает изоэлектрическое состояние
системы. Противоионы, имеющие заряд,
противоположный заряду поверхности,
компенсируют его. Для компенсации заряда
потенциалопределяющих ионов требуется
всегда одно и тоже (эквивалентное им)
количество противоионов.Это количество
противоионов располагается в слое
разной толщины в зависимости от
концентрации раствора. Поэтому с
увеличением концентрации электролита
толщина диффузного слоя будет уменьшаться,
и
-потенциал
тоже будет уменьшаться. Чем больше
концентрация электролита, тем в более
в тонком слое происходит компенсация
заряда поверхности.
и возникает изоэлектрическое состояние
системы. Противоионы, имеющие заряд,
противоположный заряду поверхности,
компенсируют его. Для компенсации заряда
потенциалопределяющих ионов требуется
всегда одно и тоже (эквивалентное им)
количество противоионов.Это количество
противоионов располагается в слое
разной толщины в зависимости от
концентрации раствора. Поэтому с
увеличением концентрации электролита
толщина диффузного слоя будет уменьшаться,
и
-потенциал
тоже будет уменьшаться. Чем больше
концентрация электролита, тем в более
в тонком слое происходит компенсация
заряда поверхности.
10.11.Влияние валентности противоиона на дэс.
Влияние валентности противоиона на ДЭС показано на рис. 10.13.
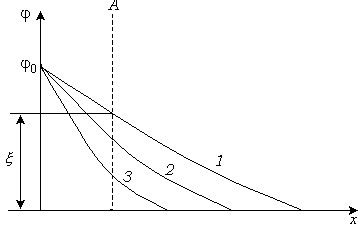
Рис.
10.13. Влияние валентности противоиона
на ДЭС:
![]() ;
;
![]() ;
;
![]() .
.
Мицелла
в избытке
имеет формулу
![]() .
Если к золю
добавить нитраты
,
.
Если к золю
добавить нитраты
,
![]() или
или
![]() одинаковой концентрации, сжатие ДЭС
произойдет тем сильнее, чем выше
валентность иона. Чем выше валентность
иона, тем сильнее ион притягивается к
поверхности, тем меньше ионов надо для
компенсации заряда поверхности, тем
тоньше ДЭС и меньше значение
-потенциала.
Валентность сильнее влияет на величину
ДЭС и величину
-потенциала,
чем концентрация.
одинаковой концентрации, сжатие ДЭС
произойдет тем сильнее, чем выше
валентность иона. Чем выше валентность
иона, тем сильнее ион притягивается к
поверхности, тем меньше ионов надо для
компенсации заряда поверхности, тем
тоньше ДЭС и меньше значение
-потенциала.
Валентность сильнее влияет на величину
ДЭС и величину
-потенциала,
чем концентрация.
Для объяснения влияния концентрации электролита и валентности иона на ДЭС достаточно представлений Гуи-Чепмена. Для объяснения влияния радиуса иона на ДЭС необходимо привлечь представления Штерна о том, что ионы способны адсорбироваться, и на адсорбционную способность иона влияет его гидратация.
10.12. Влияние радиуса иона на дэс.
Рассмотрим влияние радиуса иона на ДЭС на примере ионов щелочных металлов, радиус которых увеличивается в лиотропном ряду (лиотропным называется ряд по способности ионов взаимодействовать со средой):
![]()
В этом же ряду увеличивается адсорбционная способность иона и усиливается сжатие ДЭС. Влияние радиуса ДЭС показано на рис. 10.14.
Рис.
10.14. Влияние радиуса ионов щелочных
металлов на толщину ДЭС:
![]() ;
;
![]() ;
;
![]() .
.
На адсорбционную способность ионов влияет их поляризуемость и гидратация, что определяется кристаллохимическим радиусом иона. С увеличением кристаллохимического радиуса ионов их дипольный момент и поляризуемость увеличиваются, а гидратация уменьшается. Чем меньше кристаллохимический радиус иона, тем сильнее гидратирован такой ион и тем хуже он адсорбируется.Менее гидратированный ион с большим дипольным моментом обладает высокой адсорбционной активностью и сильно снижает заряд поверхности.
Величина кристаллохимического
радиуса ионов
и радиуса гидратированных ионов R,
в ряду щелочных металлов при переходе
от
![]() к
к
![]() и далее к
и далее к
![]() изменяются антибатно (рис. 10.15)
изменяются антибатно (рис. 10.15)
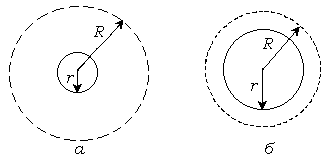
Рис. 10.15. Кристаллохимический радиус и радиус гидратированного иона - ; б – .
В таблице (Таблица 1) приведены размеры, степень гидратации и поляризуемость ионов и .
Таблица 1. Свойство ионов щелочных металлов.
№ пп |
Ион Параметр |
Li+ |
Na+ |
1. |
Кристаллохимический
радиус,
,
м
|
6 |
9,5 |
2. |
Радиус гидратированного
иона,
|
37 |
33 |
3. |
Степень гидратации, |
7 |
5 |
4. |
Поляризуемость,
|
3 |
19 |
С увеличением кристаллохимического радиуса ионов их гидратация уменьшается, что позволяет им ближе подходить к поверхности, поляризуемость увеличивается, что приводит к увеличению адсорбционной способности. Следовательно с увеличением радиуса ионов они сильнее сжимают ДЭС. Таким образом, объяснение влияния радиуса иона на ДЭСможет быть дано в рамках представлений Штерна, учитывающих размеры ионов и их гидратацию.
