
- •Моз України
- •Передмова до першого видання
- •Ф. Бекон
- •І.В.Давидовський вступ
- •Термінологія
- •Перші документальні автопсії. Дослідження з допомогою мікроскопа
- •Медичний факультет імп. Київського університету св. Володимира — Київський медичний інститут
- •Медичний факультет Львівського університету — Львівський медичний інститут
- •Медичний факультет імп. Новоросійського університету - Одеський медичний інститут
- •Кишенсъкий
- •Розділ 1 елементи ультраструктурної патології клітини
- •Балтики
- •Причини пошкодження клітин можуть бути різні:
- •Усю різноманітність реакцій клітини в патології можна звести до таких ознак:
- •Патологія поверхневого комплексу
- •Патологія клітинних з'єднань
- •Патологія органел цитоплазми
- •Патологія ядра
- •1. Пошкодження хромосом:
- •II. Пошкодження мітотичного апарату:
- •III. Розлад цитотомії:
- •Хромосомні аберації та хромосомні хвороби
- •Структури клітини та їх можливі зміни при патологічних станах, хворобах і дії різноманітних чинників
- •Структури клітини та їх можливі зміни при патологічних станах, хворобах і дії різноманітних чинників
- •Структури клітини та їх можливі зміни при патологічних станах, хворобах і дії різноманітних чинників
- •Структури клітини та їх можливі зміни при патологічних станах, хворобах і дії різноманітних чинників
- •Розділ 2 морфологія порушень обміну речовин. Дистрофії. Некроз
- •Загальна характеристика
- •Паренхіматозні дистрофії
- •Мал. Жирова дистрофія печінки, макропрепарат
- •Мал. Жирова дистрофія печінки, мікропрепврат
- •Стромально-судинні мезенхімальні дистрофії
- •Мал.Фібриноїдний некроз артеріоли
- •Класифікація змішаних дистрофій
- •Класифікація ендогенних пігментів
- •Класифікація некрозу
- •Термінологія до розділу "морфологія порушень обміну речовин. Дистрофії. Некроз"
- •Ситуаційні завдання до розділу "морфологія порушень обміну речовин. Дистрофії. Некроз"
- •Розділ з порушення крово - та лімфообігу
- •Загальна характеристика
- •Класифікація порушень кровопостачання
- •Класифікація порушень кровопостачання
- •Міграція ембола
- •Термінологія до розділу "порушення крово- та лімфообігу"
- •Питання з комп'ютерної програми та самонавчання до розділу "порушення крово- та лімфообігу"
- •Ситуаційні завдання до розділу "порушення крово- та лімфообігу"
- •Запалення. Імунопатологічні процеси Ніщо не відбувається
- •М. В.Ломоносов загальна характеристика
- •1. Система т- та в-лімфоцитів.
- •2. Система моноцитарних фагоцитів.
- •3. Системна поліморфпоядерного лейкоцита, або система мікрофага.
- •Класифікація ексудативного запалення
- •Класифікація грануломатозного запалення
- •Динаміка розвитку туберкульозного запалення (а.І.Струков, в.В.Серов, 1979)
- •Імунопатологічні процеси
- •Термінологія до розділу "запалення. Імунопатологічні процеси"
- •Питання з комп 'ютерної програми та самонавчання до розділу "запалення. Імунопатологічні процеси"
- •Ситуаційні завдання до розділу "запалення. Імунопатологічні процеси"
- •Розділ 5 пристосувально-компенсаторні процеси
- •Загальна характеристика
- •Класифікація регенерації
- •Форми репаративної регенерації
- •Термінологія до розділу
- •Питання з комп 'ютерної програми та самонавчання до розділу "пристосувально-компенсаторні процеси"
- •Ситуаційні завдання до розділу 'тіристосувально-компенсаторні процеси"
- •Пухлини Красота і велич людського
- •Загальна характеристика
- •Класифікація видів росту та типів будови пухлини пухлина
- •Мал. Метастаз аденокарциноми в реґіонарний лімфатичний вузол
- •Мал. Віддалені метастази у печінку
- •Метастазування пухлини
- •Пухлинна прогресія
- •Порівняльна характеристика доброякісних та злоякісних пухлин
- •Мал. Внутрішньопротокова папілома молочної залози
- •Мал. Фолікулярна аденома щитоподібної залози
- •Мал. Рак на місці, шийка матки
- •Мал. Аденокарцинома товстої кишки
- •Мал. Слизовий рак шлунку
- •Мал. Солідний рак легені
- •Мал. Медулярний рак щитоподібної залози
- •Пухлини молочної залози
- •Пухлини жіночого статевого тракту
- •Шийка матки
- •Тіло матки
- •Маткові труби
- •Бартолінова залоза
- •Яєчники
- •II. Пухлини строми статевого тяжа
- •III. Ліпідно-клітинні (ліпоїдно-клітинні) пухлини
- •IV. Герміногенні пухлини
- •I. Герміногенні пухлини
- •Ендокринні залози
- •Щитовидна залоза
- •Наднирники
- •II. Предракові стани
- •III. Пухлини і ураження меланогенної системи
- •IV. Пухлини м 'яких тканин і пухлиноподібні процеси
- •V. Пухлини і пухлиноподібні зміни гематопоетичної ілімфоїдної тканини
- •Мезенхімальні пухлини
- •Рівень проростання шарів шкіри меланомою (за Кларком)
- •Пухлини нервової системи та оболонок мозку
- •II. Пухлини, що походять з оболонок нервів
- •III. Пухлини мозкових оболонок і споріднених тканин
- •Пухлини у дітей
- •Термінологія до розділу "пухлини"
- •Питання з комп 'ютерної програми та самонавчання до розділу "пухлини"
- •Ситуаційні завдання до розділу 'пухлини"
- •Приложение (для иностранных студентов) ситуационные задачи 1 категории сложности
- •Ситуационные задачи II категории сложности
- •Вопросы для компьютерного контроля
- •Вопросы для бескомпьютерного контроля
- •Основна література
1. Система т- та в-лімфоцитів.
Ця система забезпечує перебіг "імунних" процесів, до яких відносять такі, що пов'язані з реакціями антиген-антитіло та клітинним цитолізом в результаті дії Т- та В-лімфоцитів. Проявом їх є імунне запалення (А.1.Струков,1982).
2. Система моноцитарних фагоцитів.
У рамках її діяльності виникає грануломатозне (в минулому — специфічне) запалення. Воно виникає в результаті дії деяких мікроорганізмів (наприклад, мікобактерій туберкульозу, блідоїтрепонеми та ін.) або хімічних речовин на систему моноцитарних фагоцитів (гістіоцитарно-макрофагальну систему). Виникнення гранульоми в цих випадках зумовлює відмежування патогенного агента від здорових тканин, його фагоцитоз та елімінацію. Загальноприйнятою є схема клітинних перетворень у даній системі: моноцит — макрофаг — епітеліоїдна клітина — гігантська клітина типу чужорідного тіла — гігантська клітина типу Пирогова — Лангханса.
3. Системна поліморфпоядерного лейкоцита, або система мікрофага.
Ця система представлена гранулоцитами, в основному нейтрофілами; вона стабільно реагує на проникнення в тканини більшості бактерій, викликаючи розвиток гнійного запалення.
Встановлено, що нейтрофіли перебувають в організмі в стані спокою та активації. Перші — локалізуються в крові та кістковому мозку, другі — в тканинах або вогнищах запалення. У крові нейтрофіл не може виконувати специфічну функцію (фагоцитоз, секреція). Його перебування в крові розглядається тільки як тимчасовий етап (живе декілька годин) існування, як форма переміщення клітини від місця утворення (кістковий мозок) до місця виконання специфічної функції (тканина, вогнище запалення). При цьому циркулюючі в крові клітини перетворюються в маргінальні — фіксовані біля поверхні ендотеліоцита, особливістю яких є підвищення адгезивних властивостей.
Запалення є тристадійним процесом, який має певну динаміку в своєму розвитку .
Альтерація є ініціальна, або початкова стадія, що характеризується пошкодженням тканин. Морфологічно при цьому спостерігаються різні види дистрофії аж до виникнення некрозу клітин та структур позаклітинного середовища. Порушення метаболізму в зоні пошкодження супроводжується значними біохімічними та фізико-хімічними змінами паренхіматозно-стромальних елементів. Результатом цих змін є нагромадження різноманітних вазоактивних та хемотаксичних речовин, які в подальшому визначають особливості розвитку запального процесу. Вони продукуються клітинами, мікробами, а також містяться в плазмі крові.
Крім того, у вогнищі запалення відбувається деполімеризація білково-глікозаміногліканових комплексів, з'являються вільні амінокислоти, уронові кислоти, поліпептиди, низькомолекулярні полісахариди. У результаті підвищується осмотичний тиск у тканинах, відбувається їх набухання і затримка в них води. Нагромадження продуктів жирового (жирні кислоти) та вуглеводного (молочна кислота) обміну супроводжується розвитком ацидозу та гіпоксії. Важливе значення має активація перекісного окислення ліпідів, що спостерігається в результаті пошкодження мембранних структур клітини, а також нагромадження медіаторів.
Існують різні критерії їх систематизації, часто їх класифікують за хімічною структурою: наприклад, біогенні аміни (гістамін, серотонін), поліпептиди (бридикінін, паллідін) та білки (фракції комплемента, ферменти лізосом), продукти арахідонової кислоти (простогландіни, лейкотрієни). Інколи медіатори розрізняють за їх походженням на гуморальні (Сз-фракція комплементу, наприклад, анафілаксин) та клітинні (гістамін, грану-лоцитарні фактори, лімфокіни). Гуморальні (плазменні) медіатори характеризуються генералізованим ефектом, спектр їх дії ширший, ніж у клітинних медіаторів, ефекти яких локальні.
Медіатори запалення залежно від механізмів їх виходу з клітин класифікують на медіатори нецитотоксичної' дії та цитотоксичної дії. У першому випадку має місце вихід медіаторів шляхом фізіологічного екзоцитозу, у другому — спостерігається руйнування клітини, в результаті чого медіатори надходять у навколишнє середовище. Один і той же медіатор (гістамін, серотонін) може проникати в нього і тим, і іншим шляхом (із лаброцита або тромбоцита).
Залежно від терміну впливу на тканини розрізняють медіатори миттєвої (кініни, анафілотоксини) та уповільненої дії (монокіни, лімфокіни); медіатори прямої та непрямої (опосередкованої) дії. До перших відносять медіатори, які в процесі запалення виділяються дуже швидко (гістамін, серотонін), до других - медіатори, які з'являються пізніше (фракції комплементу, гранулоцитарні фактори нейтрофілів).
Зазначена класифікація медіаторів запалення має умовний характер і може бути використана лише для визначення загальних орієнтирів при інтерпретації механізмів розвитку запального процесу.
На стадії ексудації продукти обміну речовин та деструкції тканин (некрозу) в зоні місцевого порушення гомеостазу викликають зміни проникливості мікросудин. Це характеризується виходом в зону пошкодження різноманітних компонентів плазми крові та клітин, що виділяють біологічно активні речовини.
Особливості крово- та лімфопостачання у вогнищі запалення на стадії ексудації залежать від багатьох факторів, у тому числі від характеру пошкодження, виду пошкодженого органа або тканини та ін. На цій стадії спостерігаються структурно-функціональні зміни судин: порушення тонусу їх та перфузія кров'ю або лімфою, зміни проникливості стінок, реологічних властивостей крові та стану клітинних елементів.
Ю.Конгейм (1878) детально описав зміни в системі мікросудин при запаленні, в тому числі: активну вазодилятацію, зміну швидкості та характеру кровотоку; встановив підвищення проникливості судин, розвиток набряку, еміграцію лейкоцитів.
Сучасними дослідженнями встановлено, що компоненти плазми та клітинні елементи виходять за межі гемомікроциркуляторного русла трансендотеліальним шляхом або ж по міжендотеліальних щілинах. У забезпеченні процесів ексудації та еміграції клітинних елементів надається певне значення взаємовідносинам гідродинамічного та колоїдно-осмотичного тиску, розвитку гіпоксії та ацидозу в пошкоджених тканинах (схема XIX).
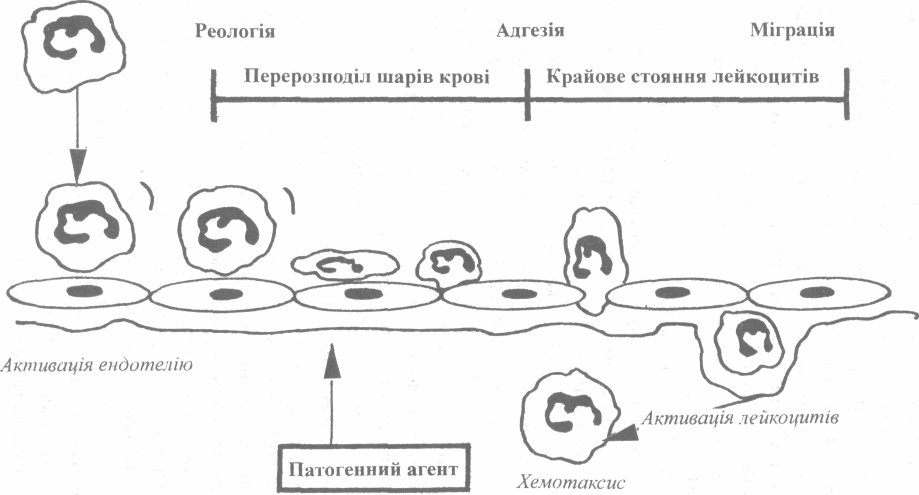
Компоненти клітинної кооперації виконують в зоні запалення чітко розмежовані функції. Так, в протимікробному захисті основну роль виконують нейтрофіли. Вони першими вступають у контакт з інфектом і блокують його проникнення у внутрішнє середовище організму, їх дія стосовно збудника захворювання проявляється у вигляді фагоцитозу або екзоцитозу, в результаті чого клітини гинуть. Біологічне значення екзоцитозу недостатньо вивчене. Найбільш очевидною є його роль у розвитку запалення. Вважається, що виділяючи нейтральні та кислі протеази деякі неферментні білки нейтрофілів забезпечують тим самим розщеплення комплементу, антитіл та інших гуморальних факторів. Роль екзоцитозу в антимікробному захисті також мало вивчена. Зокрема, є припущення про те, що лізосомні катіонні білки та гістони, що звільняються при загибелі нейтрофілів, пригнічують дієздатність окремих збудників захворювання (В.Е.Пигаревський,1978).
Давно відома також і лізуюча дія нейтрофілів на змертвілі тканини: її пояснюють виходом гранул із зруйнованих клітин, що дає можливість розглядати як клітини з голокриновим типом секреції. Існує точка зору, що нейтрофіли можуть виділяти свій секрет у позаклітинне середовище шляхом зазначеного вище екзоцитозу і без руйнування клітин, тобто до певного моменту секреція не супроводжується розривом клітинної мембрани — відбувається секреція за мерокриновим типом.
Дегрануляція нейтрофілів при екзоцитозі суттєво відрізняється від інтрацелюлярної дегрануляції, яка завжди супроводжується виділенням у фагосом як первинних, так і вторинних гранул. Важливим проявом секреторної функції нейтрофілів є те, що поруч із гранулами та їх вмістом ці клітини можуть виділяти у міжклітинне середовище біологічно активні оксиданти.
Нейтрофіли та макрофаги виконують у зоні запалення на другій його стадії бактерицидну та фагоцитарну функції, а також продукують біологічно активні речовини, що забезпечують різноманітні ефекти, у першу чергу посилюють саму судинну реакцію та хемоа-тракцію запалення (схема XX). Пізніше до нейтрофільної реакції приєднується макрофагальна інфільтрація, що характеризує початок інкапсуляції з формуванням периферійного клітинного валу.
Продуктивна (проліферативна) стадія є стадією репаративною. Для неї характерним є вихід у зону запалення великої кількості макрофагів, що не тільки розмножуються, але й виділяють біологічно активні речовини - монокіни, які притягують фібробласти та стимулюють їхнє розмноження, а також активують процеси новоутворення судин. В інфільтраті виявляють лімфоцити, інколи плазмоцити. Поступово клітини інфільтрату гинуть і залишаються переважно фібробласти.
Макрофаги входять до складу вище зазначеної системи мононуклеарних фагоцитів. У внутрішніх органах вони представлені макрофагами — резидентами, особливістю яких є можливість повільного самооновлення. Різновидностями макрофагів є макрофаги сполучної тканини (гістіоцити), легеневі макрофаги, купферовські клітини печінки, макрофаги лімфатичних вузлів, селезінки. Спочатку в зону запалення мігрують моноцити крові, які далі трансформуються в "запальні", або "ексудативні", "макрофаги", кількість яких у зоні запалення поступово зростає, вони виконують секреторну та фагоцитарну функції. Зрілі макрофаги трансформуються в епітеліоїдні клітини, а в подальшому велетенські клітини двох типів: клітини типу Пирогова-Лангханса, у складі яких не більше 30 розташованих по периферії ядер та другий тип: із 30 та більше ядер типу велетенських клітин чужорідного тіла з центрально розташованими або хаотично розкиданими в цитоплазмі.
Відносно механізму утворення велетенських клітин висловлено припущення про можливість поділу ядер без поділу клітини, злиття макрофагів між собою або поєднання зазначених процесів.
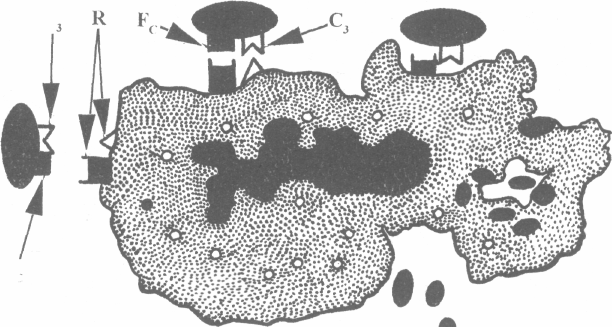
На поверхні макрофага є рецептори для Fc-фрагменту IgG імуно-глобулінів та рецептори для Сз-компонента системи комплементу. Завдяки цьому відбувається адгезія макрофага з об'єктом фагоцитозу — антитілом.
Існують дві форми запалення: ексудативне запалення та продуктивне запалення.
Основною ознакою ексудативного запалення є вихід із просвіту мікросудин (у першу чергу посткапілярів та венул) плазми крові та форменних елементів, тобто утворення запальної рідини, або ексудату. Альтеративні зміни при цьому проявляються пошкодженням стінок судин, розвитком дистрофії клітин або некрозу, десквамацією клітин (слизових та серозних оболонок). Проліферативні процеси виражені нерізко.
Розрізняють такі форми ексудативного запалення (схема XXI):
1. Серозне запалення.
2. Фібринозне запалення.
3. Гнійне запалення.
4. Катаральне запалення.
5. Геморагічне запалення.
6. Гнильне запалення.
7. Змішані форми.
Серозне запалення характеризується утворенням серозного ексудату, в складі якого до 2% білка та невелика кількість клітинних елементів. Серозний ексудат може проникати дифузно в тканину органа, призводячи до розвитку запального набряку, може нагромаджуватися в тій або іншій порожнині (плеври, перикарду, очеревини) або перебувати на поверхні слизових оболонок та в складі епідермісу (опікова хвороба, серозний катар), рідше міститься у внутрішніх органах — легені, нирки та ін.
Мал. Серозний ексудат у плевральній
порожнині
Зокрема, при серозному екстракапілярному гломерулонефриті клубочки збільшуються в розмірах, у просвітах їх капілярних петель та мезангії нагромаджується серозна рідина, в якій містяться лейкоцити, виникають дистрофічні зміни компонентів капілярної стінки (ендотеліоцитів, базальної мембрани, мезангіоцитів, подоцитів). Інколи лейкоцити виповнюють більшу частину просвіту капіляра (мал.35).
Зовні це прозора рідина жовтуватого кольору, у складі якої виявляються лейкоцити, лімфоцити, десквамовані клітини серозних оболонок, альвеолоцити та ін.
Причинами серозного запалення можуть бути термічні фактори (опікова хвороба), інфекційні агенти (мікобактерії туберкульозу, диплококи Френкеля, менінгококи), аутоінтоксикації.
Схема XXI
