
- •Міністерство охорони здоров’я україни
- •Глава 1. Предмет і завдання патологічної фізіології. Основні поняття
- •Глава 2. Патогенна дія факторів зовнішнього середовища…………………….........37
- •Глава 3. Роль спадковості в патологічній фізіології………………...…………65
- •Глава 4. Реактивність та її роль у патологічній фізіології.…………………….83
- •Глава 5. Патофізіологія імунної системи…………………………………...…..96
- •Глава 6. Патологічна фізіологія сполучної тканини…………………….……129
- •Глава 11. Патологічна фізіологія тканинного росту……………………..….214
- •Глава 12. Типові порушення обміну речовин…………………….…………229
- •Глава 13. Інфекційний процес. Гарячка…………………………………..…259
- •Глава 14. Голодування…………………………..……………………………276
- •Глава 15. Порушення обміну вітамінів……………………………………….291
- •Глава 16. Гіпоксія………………………………………………………………303
- •Глава 17. Патологічна фізіологія системи крові……………………….……..311
- •Глава 18. Патологічна фізіологія системного кровообігу……………..……339
- •Глава 19. Патологічна фізіологія системи зовнішнього дихання……………363
- •Глава 20. Патологічна фізіологія травлення……………………….…………379
- •Глава 21. Патологічна фізіологія печінки………………………..……………389
- •Глава 22. Патологічна фізіологія cечовидільної системи……………….……399
- •Глава 23. Патологічна фізіологія ендокринної системи………………...……411
- •Глава 24. Патологічна фізіологія нервової системи……………………..……428
- •Глава 25. Екстремальні стани...….………………………………………..……437
- •Перелік скорочень
- •Передмова
- •Глава 1. Предмет і завдання патологічної фізіології. Основні поняття загальної нозології. Вчення про хворобу
- •1.1. Основні поняття загальної нозології
- •1.2.2. Класифікація хвороб
- •1.2.3. Основні періоди розвитку хвороби
- •1.2.4. Реанімація
- •1.3. Вчення про загальну етіологію і патогенез
- •1.3.1. Роль причин і умов у виникненні хвороби
- •1.3.2. Принципи етіотропної профілактики і терапії.
- •1.3.3. Основні положення патогенезу
- •1.3.4. Генералізація і локалізація патологічного процесу.
- •Контрольні питання
- •Глава 2. Патогенна дія факторів зовнішнього середовища
- •2.1. Патогенна дія іонізуючого випромінювання
- •2.2. Патогенна дія на організм інфрачервоних і ультрафіолетових променів
- •2.3. Патогенна дія електричної енергії.
- •2.4. Вплив на організм факторів космічного польоту
- •2.5. Патогенна дія на організм зміненого атмосферного тиску
- •2.6. Патогенна дія біологічних факторів на організм
- •2.7. Патогенна дія хімічних факторів на організм
- •2.8. Патологічна фізіологія алкоголізму, наркоманії та токсикоманії
- •2.8.1. Патофізіологічна характеристика алкоголізму
- •2.8.2. Патофізіологічна характеристика наркоманій і токсикоманій
- •Контрольні питання
- •Глава 3. Роль спадковості в патологічній фізіології
- •3.1. Причини спадкової патології
- •3.2. Загальні закономірності патогенезу спадкових захворювань
- •3.3. Класифікація форм спадкової патології
- •3.4. Методи вивчення спадкової патології
- •3.5. Характеристика спадкових хвороб
- •3.5.1. Генні хвороби (молекулярно-генетичні)
- •3.5.2. Хромосомні хвороби
- •3.5.3. Хвороби зі спадковою схильністю
- •3.6. Важливість спадкових факторів у патології людини
- •3.7. Принципи лікування і профілактики спадкових хвороб та хвороб зі спадковою схильністю.
- •Контрольні питання
- •Глава 4. Реактивність та її роль у патологічній фізіології.
- •4.1. Види реактивності
- •4.2. Форми і показники реактивності
- •4.3. Механізми реактивності
- •4.4. Резистентність
- •4.4.1. Основні компоненти неспецифічної резистентності
- •Контрольні питання
- •Глава 5. Патологічна фізіологія імунної системи
- •5.1. Первинні імунодефіцити
- •5.2. Вторинні імунодефіцити
- •5.3. Алергія
- •5.3.1. Класифікація алергічних реакцій
- •5.3.2. Механізми формування алергічних реакцій
- •5.3.3. Анафілактичні алергічні реакції (гіперчутливість і типу)
- •5.3.4. Цитотоксичні алергічні реакції (гіперчутливість iі типу)
- •5.3.5. Імунокомплексні алергічні реакції (гіперчутливість iіі типу)
- •5.3.6. Сповільнені алергічні реакції (гіперчутливість IV типу)
- •5.3.7. Автоімунні захворювання
- •5.3.9. Основні методи лікування алергічних захворювань
- •Контрольні питання
- •Глава 6. Патологічна фізіологія сполучної тканини
- •6.1. Структура, особливості та функції сполучної тканини
- •Таблиця 6.1. Гістамінові рецептори: переважна локалізація та наслідки подразнень
- •Таблиця 6.2. Генетичні типи колагену
- •6.2. Системні хвороби сполучної тканини
- •Контрольні питання
- •Глава 7. Патологічна фізіологія клітини
- •7.3. Молекулярні механізми пошкодження клітин.
- •7.4. Ознаки пошкодження клітини.
- •7.5. Захисно-компенсаторні реакції клітини у відповідь на її пошкодження:
- •Контрольні питання
- •Глава 8. Старіння
- •8.1. Класифікація старіння
- •8.2. Теорії старіння
- •8.3. Зміни на молекулярному та клітинному рівнях
- •8.4. Профілактика старіння
- •Контрольні питання
- •Глава 9. Патологічна фізіологія периферичного кровообігу
- •9.1. Артеріальна гіперемія
- •9.2. Венозна гіперемія
- •9.3. Ішемія
- •9.4. Стаз
- •9.5. Тромбоз
- •9.6. Емболія
- •9.7. Порушення мікроциркуляції
- •Контрольні питання
- •Глава 10. Запалення
- •10.1. Етіологія і патогенез запалення
- •Біологічно активні речовини – медіатори (модулятори) запалення
- •10.2. Класифікація запалення
- •10.3. Основні фізико-хімічні зміни в осередку запалення
- •10.5. Загальні ознаки запалення
- •10.6. Види ексудатів
- •10.7. Фагоцитоз
- •10.8. Хронічне (гранульоматозне) запалення
- •10.9. Завершення запалення
- •10.10. Значення запалення для організму
- •Контрольні питання
- •Глава 11. Патологічна фізіологія тканинного росту
- •11.1. Класифікація порушень тканинного росту
- •11.2. Гіпербіотичні процеси
- •11.2.1. Гіпертрофія та гіперплазія
- •11.2.2. Регенерація
- •11.2.3. Пухлини
- •11.3. Гіпобіотичні процеси
- •11.3.1. Атрофія
- •11.3.2. Дистрофія
- •Контрольні питання
- •Глава 12. Типові порушення обміну речовин
- •12.1. Основний та енергетичний обміни
- •12.2. Патофiзiологiя водно-електролітного обміну
- •12.2.1. Порушення водно-електролітної рівноваги (дисгiдрiя)
- •12.2.2. Набряки
- •12.3. Патофiзiологiя мiнерального обмiну
- •12.4. Патофізіологія вуглеводного обміну
- •12.5. Патологія жирового обміну
- •12.6. Патофізіологія білкового обміну
- •Контрольні питання
- •Глава 13. Інфекційний процес. Гарячка
- •13.1. Інфекційний процес
- •13.2. Гарячка
- •13.2.1. Етіологія
- •13.2.2. Механізм розхвитку гарячки
- •13.2.3. Стадії гарячки
- •13.2.4. Зміни в органах та системах при гарячці
- •13.2.5. Біологічне значення гарячки
- •13.2.6. Покази і принципи жарознижуючої терапії.
- •13.2.7. Поняття про піротерапію
- •13.2.8. Гіпертермія.
- •13.2.9. Гарячки нез’ясованої етіології.
- •Контрольні питання
- •Глава 14. Голодування
- •14.1. Повне голодування.
- •14.2. Неповне голодування
- •14.3. Білково-калорійна недостатність.
- •14.3.1. Квашіоркор
- •14.3.2. Аліментарний маразм
- •Відмінні ознаки квашіоркору і аліментарного маразму
- •14.3.3. Спру
- •14.4. Часткове голодування
- •14.5. Лікувальне голодування
- •Контрольні питання
- •Глава 15. Порушення обміну вітамінів
- •15.1. Жиророзчинні вітаміни
- •15.1.1. Гіповітаміноз а
- •15.1.2. Гіпервітаміноз а
- •15.1.3. Авітаміноз d
- •15.1.4. Гіповітаміноз d
- •15.1.5. Гіпервітаміноз d
- •15.1.6. Гіповітаміноз к
- •15.1.7. Гіповітаміноз е
- •15.2. Водорозчинні вітаміни
- •15.2.2. Авітаміноз в1 (хвороба бері-бері)
- •15.2.3. Гіповітаміноз в2
- •15.2.4. Авітаміноз рр
- •15.2.5. Гіповітаміноз в6
- •15.2.6. Гіповітаміноз в12
- •15.2.7. Гіповітаміноз в9
- •15.2.8. Гіповітаміноз в3
- •15.2.9. Гіповітаміноз н
- •Контрольні питання
- •Глава 16. Гіпоксія
- •16.1. Класифікації гіпоксій.
- •16.2. Види гіпоксій
- •16.3. Компенсаторно-пристосувальні механізми при гіпоксії
- •16.5. Загальні принципи корекції і профілактики гіпоксії.
- •Контрольні питання
- •Глава 17. Патологічна фізіологія системи крові
- •17.3.4. Лейкози
- •17.3.5. Лейкемоїдні реакції
- •17.4. Порушення гемостазу
- •17.4.1. Тромботичний синдром
- •17.4.2. Геморагічні діатези
- •17.4.3.Синдром дисемінованого внутрісудинного згортання крові (двз-синдром, тромбогеморагічний)
- •Контрольні питання
- •Глава 18. Патологічна фізіологія системного кровообігу
- •18.1. Недостатність кровообігу
- •Недостатність кровообігу може бути зумовлена:
- •18.2. Патологічна фізіологія кровообігу, зумовлена порушенням функції серця.
- •18.2.1.Механізми виникнення недостатності серця
- •18.2.2.Механізми компенсації
- •18.2.3.Гостра серцева недостатність.
- •18.2.4. Хронічна серцева недостатність
- •18.2.5. Аритмії
- •18.3. Патологічна фізіологія кровообігу, зумовлена порушенням функції судин
- •18.3.1. Атеросклероз
- •18.3.2. Артеріальні гіпертензії. Гіпертонічна хвороба
- •18.3.3. Артеріальні гіпотензії. Гіпотонічні стани
- •Контрольні питання
- •Глава 19. Патологічна фізіологія зовнішнього дихання
- •19.1. Недостатність дихання
- •19.2. Порушення альвеолярної вентиляції
- •19.3. Паренхіматозна недостатність зовнішнього дихання.
- •19.4.Основні патологічні процеси і захворювання зовнішнього дихання.
- •19.5. Принципи і шляхи фармакотерапії дихальної недостатності.
- •19.6. Порушення нереспіраторних функцій легень.
- •1. Легеневі об’єми і ємкості:
- •20.2. Порушення секреції шлунка
- •20.3. Порушення моторики шлунка
- •20.4. Виразкова хвороба шлунка і дванадцятипалої кишки
- •20.5. Гастрити
- •20.6. Панкреатит
- •20.7. Порушення травлення в кишках.
- •Контрольні питання
- •Глава 21. Патологічна фізіологія печінки
- •21.1. Класифікація хвороб печінки
- •21.2. Етіологія
- •21.3. Недостатність печінки
- •21.4. Порушення захисної функції печінки
- •21.5. Порушення жовчоутворювальної і жовчовидільної функції печінки
- •21.6. Жовтяниця
- •21.7. Жовчнокам’яна хвороба
- •21.8. Холецистит
- •21.9. Гепатити
- •21.10 Цироз печінки
- •Контрольні питання
- •Глава 22. Патологічна фізіологія сечовидільної системи
- •22.1. Порушення функції клубочків нефронів
- •22.2. Порушення функцій канальців
- •22.3. Патологічні прояви порушень складу сечі
- •22.4. Основні механізми порушення функції нирок
- •22.5. Недостатність нирок причини та механізм розвитку, клінічні прояви.
- •22.6. Загальна характеристика механізмів розвитку основних захворювань нирок
- •Контрольні питання
- •Глава 23. Патологічна фізіологія ендокринної системи
- •23.1. Механізми ендокринних порушень
- •23.2. Компенсаторно-пристосувальні механізми при ендокринній патології
- •23.3. Причини ендокринних порушень
- •23.4. Порушення функцій гіпофіза
- •23.5. Порушення функції щитоподібної залози
- •23.6. Порушення функцій паращитоподібних залоз
- •23.7. Порушення функцій надниркових залоз
- •23.8. Порушення функцій статевих залоз
- •Контрольні питання
- •Глава 24. Патологічна фізіологія нервової системи
- •24.1. Причини та умови виникнення порушень діяльності нервової системи
- •24.2. Розлади сенсорної функції нервової системи
- •24.3. Патофізіологія болю
- •24.4. Порушення рухової функції нервової системи
- •24.5. Порушення нейро-трофічної функції нервової системи
- •24.6. Розлади мозкового кровообігу
- •24.7. Загальні поняття про хвороби, викликані емоційно-психічною діяльністю
- •Контрольні питання
- •Глава 25. Екстремальні стани
- •25.1. Класифікація екстремальних факторів.
- •Контрольні питання
- •3.1. Тестові завдання для самоконтролю Частина перша. Нозологія
- •Глава 1. Предмет і завдання патологічної фізіології. Основні поняття загальної нозології. Вчення про хворобу
- •Глава 2. Патогенна дія факторів зовнішнього середовища
- •Глава 3. Роль спадковості в патологічній фізіології
- •Глава 4. Реактивність та її роль у патологічній фізіології.
- •Глава 5. Патофізіологія імунної системи
- •Глава 7. Патологічна фізіологія клітини
- •Глава 8. Старіння
- •Частина друга. Типові патофізіологічні процеси
- •Глава 9. Патологічна фізіологія периферичного кровообігу
- •Глава 10. Запалення
- •Глава 11. Патологічна фізіологія тканинного росту
- •Глава 12. Типові порушення обміну речовин
- •Глава 13. Інфекційний процес. Гарячка
- •Глава 14. Голодування
- •Глава 15. Порушення обміну вітамінів
- •Глава 16. Гіпоксія
- •Частина третя. Патологічна фізіологія органів та систем
- •Глава 17. Патологічна фізіологія системи крові
- •Глава 18. Патологічна фізіологія системного кровообігу
- •Глава 19. Патологічна фізіологія системи зовнішнього дихання
- •Глава 20. Патологічна фізіологія травлення
- •Глава 21. Патологічна фізіологія печінки
- •Глава 22. Патологічна фізіологія cечовидільної системи
- •Глава 23. Патологічна фізіологія ендокринної системи
- •Глава 24. Патологічна фізіологія нервової системи
- •Глава 25. Екстремальні стани
- •3.2. Відповіді до тестових завдань Частина перша. Нозологія
- •Частина друга. Типові патофізіологічні процеси
- •Частина третя. Патологічна фізіологія органів та систем
- •Список рекомендованої літератури
- •Предметний покажчик
6.2. Системні хвороби сполучної тканини
Системні хвороби сполучної тканини (колагенози) – це особлива група хвороб, при яких спостерігається генералізоване ураження сполучної тканини. Це ураження може виявитися переважно з боку суглобів (ревматоїдний артрит), шкіри (склеродермія), судин (вузликовий періартеріїт), шкіри і м’язової тканини (дерматоміозит), а також ураження всієї сполучної тканини (системний червоний вовчак).
Ревматоїдний артрит
Ревматоїдний артрит – загальне захворювання інфекційно-алергічного походження з дифузним ушкодженням сполучної тканини, переважно суглобів з хронічним прогресуючим протіканням та поєднанням запальних і дистрофічних процесів у різних органах.
Захворювання зустрічається приблизно в 1% населення. Жінки хворіють в 3-4 рази частіше. Найбільш часто захворювання виникає між 30 та 50 роками життя.
Етіопатогенез. Причина ревматоїдного артриту повністю невідома. Довгий час обговорюється питання про можливу роль інфекційних факторів в його розвитку, проте в теперішній час немає достатніх доказів вважати безпосереднім етіологічним фактором конкретного мікроорганізма як специфічного збудника ревматоїдного артриту.
В основі патогенезу ревматоїдного артриту лежить імунний патологічний процес, що проходить в суглобовій капсулі (рис. 6.1).
А. ревматоїдний артрит Б. нормальний стан

Рис. 6.1. Патологія суглобової капсули при ревматоїдному артриті
На користь імунопатологічного та автоімунного характеру запального процесу при ревматоїдному артриті свідчить виявлення ревматоїдних факторів, що являють собою імуноглобуліни класів G або М та реагують із Fc-рецептором IgG.
Суттєве значення в розвитку РА відводиться і генетичній схильності, на що вказує виражена сімейна агрегація захворювання а також наявність у хворих антигенів другого класу головного комплексу гістосумісності HLA DR4 iDw4.
Для запалення синовіальної оболонки характерні три стадії:
І – стадія ексудативно-дистрофічних змін переважно м’яких тканин суглоба;
ІІ – стадія проліферативно-дегенеративних змін з розвитком грануляційної тканини та руйнуванням суглобових хрящів;
ІІІ – стадія перевага склеротичних змін з розвитком фіброзно-кісткового анкілозу.
Перша стадія захворювання починається гіперемією та набряком в суглобовій капсулі з подальшою інфільтрацією лімфоцитами, плазматичними клітинами та гістіоцитами. Ексудат, що утворився – стерильний, проте в синовіальній рідині визначаються антитіла до суглобової капсули і імуноглобуліни. Це свідчить про алергічну природу синовіїту. Ексудат містить значну кількість фібрину, який при відкладанні на суглобовій капсулі створює умови для розвитку ІІ (проліферативно-дегенеративної) стадії.
В другій стадії ревматоїдного артриту проходить посилена васкуляризація суглобової капсули, розростання грануляційної тканини і формування пануса, який заповнює суглобову щілину, проростає і руйнує хрящ, внаслідок чого розвивається стійка деформація ушкоджених суглобів з функціональною недостатністю. В патогенезі післязапального склерозу домінуюча роль належить взаємодії клітинних елементів в тріаді: лімфоцит-макрофаг-фібробласт. В зв’язку з цим, формування незворотніх панусних розростань навкруги суглобів є однією з причин безперервного рецидивуючого протікання ревматоїдного артриту.
В третій стадії патологічного процесу хрящ поступово замінюється сполучною тканиною, розвивається фіброзний, а потім кістковий анкілоз.
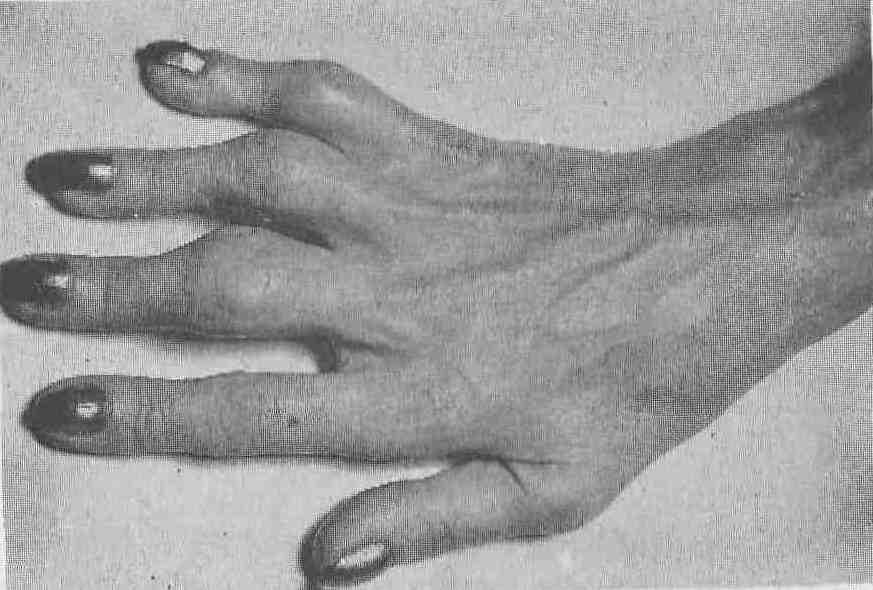
Клінічні ознаки. Здебільшого хвороба починається поступово, з болю в суглобах, порушенням їх функцій і симетричного руйнування периферичних (проксимальних) міжфалангових суглобів кистей рук (рис.6.2).
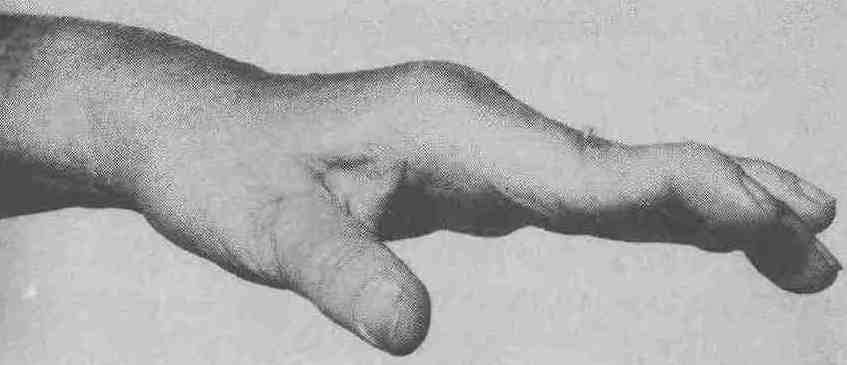
В міру розвитку хвороби атрофія м’язів та руйнування сплетіння сухожилок й суглобу призводить до обмеження рухомості суглобів, їх нестійкості, підвивихів та деформування (рис.6.3).
Рис. 6.2. Вигляд руки на початку розвитку ревматоїдного артриту: веретеноподібні пальці внаслідок розпухання проксимальних між фалангових суглобів.
Рис. 6.3. Вигляд руки при ревматоїдному артриті: деформування у вигляді «шиї лебедя»
Ревматоїдний артрит – це системна хвороба. Відсутність апетиту, втрата ваги, втомлюваність, сонливість і біль у м’язах часто виникають в процесі її розвитку і можуть передувати початку суглобових симптомів, з’являючись кількома тижнями або місяцями раніше цих ознак. Для цієї патології характерні також позасуглобові прояви, які можуть бути наступними: гематологічні (анемія, тромбоцитоз, еозинофілія); лімфатичні (лімфаденопатія, спленомегалія, синдром Фелті – поєднання спленомегалії і нейтропенії з ревматоїдним артритом); васкулітні (артеріїт пальців); серцеві (перикардит, міокардит, ендокардит); неврологічні (периферична невропатія, множинний мононеврит), тощо.
Принципи терапії. Лікування ревматоїдного артриту полягає в наступному:
Етіотропна терапія: лікування захворювань, що викликають ревматоїдний артрит та ліквідація факторів, що зумовлюють його розвиток.
Патогенетична терапія:
Протизапальна терапія: нестероїдні (диклофенак, ортофен, індометацин, напросин, флурбіпрофен, піроксикам, ібупрофен) та стероїдні препарати (преднізолон, метилпреднізолон, дексаметазон).
Базисна (імуномодулююча) терапія: солі золота, Д-пеніцилламін, хінгамін.
Імуносупресивна терапія: азатіоприн, метотрексат, циклофосфамід.
Фізичне модулювання (екстракорпоральне очищення крові за допомогою гемосорбції, плазмафереза, імуносорбції, кріофільтрації, лімфоцитафереза, дренажу лімфатичного протоку).
Фізіотерапевтичні процедури:
Кріотерапія.
Місцеві теплові процедури: компреси, місцеві ванни, аплікації парафіном, озокеритом, нафталіном.
Електроферез новокаїном, саліцілатами, анальгіном, гіалуронідазою.
Масаж суглобів в поєднанні з місцевою дією ультразвуку.
Рухова активність та дієта.
Хірургічне лікування функціонально важливих суглобів (синовектомія, синовкапсулектомія, «очищення» суглоба, ендопротезування, тощо).
Системна склеродермія – це захворювання, що характеризується дифузним ушкодженням сполучної тканини, в основі якого лежить генералізований фіброз з переважною гіперпродукцією колагену. Виникає переважно у жінок у віці 30-50 років. Термін «склеродермія» відтворює характерні зміни шкіри (склероз шкіри), проте при деяких формах на перший план можуть виступати патологічні зміни внутрішніх органів. Виділяють декілька форм склеродермії: прогресивний акросклероз, локалізована та дифузна склеродермія.
Етіопатогенез. В походженні склеродермії особливу роль відводять генетичній схильності, яка реалізується у хворобу під впливом екзогенних та ендогенних факторів: тривале охолодження, вібрація, деякі хімічні чинники (хлорвініл, трихлоретилен, бензол, анілінові барвники), лікарські препарати (блеоміцин), ендокринні порушення, тощо. Певна етіологічна роль належить вірусам (РНК-вмісним, провірусам), які здатні викликати такі порушення клітинного і гуморального імунітету як зниження кількості і функції Т-супресорів, поява гіперактивності В-лімфоцитів (збільшена сенсибілізація до калагену, надлишкова продукція лімфокінів, стимулюючих активність фібробластів); проходить накопичення автоантитіл, циркулюючих імунокомплексів. Одночасно відбувається порушення функції фібробластів в бік надлишкового фібрилогенезу; зростають антигенні властивості структур калагену.
Потрібно відмітити, що ще одним первинним «плацдармом» патологічного процесу є система мікроциркуляції: відбувається ушкодження ендотелію, фібриноїдні зміни і склероз судинної стінки, проліферація міофібробластів. Все це веде до звуження судин, порушення кровотоку і тромбозу.
Клінічна картина захворювання характеризується поліморфізмом, полісиндромністю та широким діапазоном локалізації процесу. Патологічні зміни в шкірі при склеродермії проходять в три стадії: набряк, індурація (фіброз) і атрофія. В першій стадії помітний набряк шкіри, почервоніння з подальшою блідністю пальців кисті, відчуття затерпання, повзання мурашок (синдром Рейно). В другій стадії, найбільш тривалій, спостерігається щільний набряк, шкіра суха, блискуча, гладенька та напружена. Третя – атрофічна стадія – характеризується значним витонченням шкіри, яка стягує обличчя хворого. При цьому воно стає малорухомим, маскоподібним, ротова щілина звужена, навколо рота формуються глибокі зморшки (рис. 6.4); на шкірі в лобовій області можуть бути зміни у вигляді смуг – «удар шаблею» - coup de sabre (рис. 6.5).
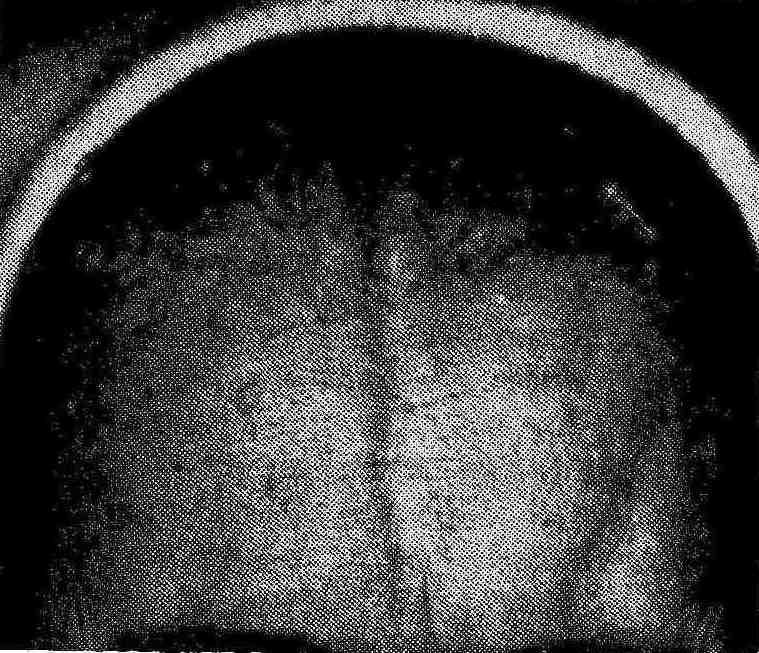
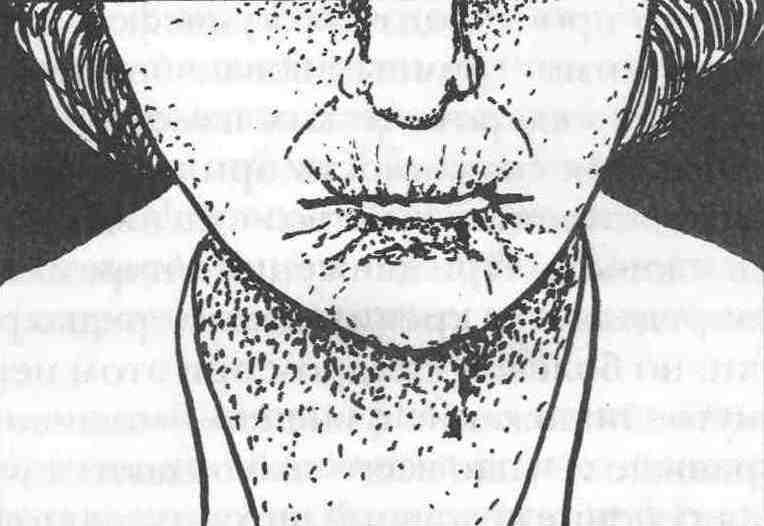
Рис. 6.4. Симптом «кисета» при системній склеродермії
Рис.6.5. Зміни шкіри в лобовій області у вигляді «удару шаблі» хворого системною склеродермією
Пальці рук «муляжні», рухи в суглобах обмежені. В подальшому може розвинутись виражена деформація кистей (склеродактилія).
Слід відмітити, що клінічна картина склеродермії може бути повною при залученні до неї додаткових як вісцеральних ознак (лімфаденопатія, гломерулонефрит, поліневрит, ураження ЦНС) так і периферичних – гіперпігментація шкіри, телеангіоектазія, поліартралгія, поліміалгія, поліміозит і так званий «сухий» синдром Шегрена, який характеризується переважним імунозапальним ураженням екзокринних залоз з порушенням їх секретної функції. Для даного синдрому притаманна сухість кон’юнктиви (ксерофтальмія) і слизової оболонки ротової порожнини (ксеростомія).
Принципи терапії
1.Покращення трофіки тканини (препарати нікотинової кислоти: нікотинамід, нікошпан).
2.Покращення мікроциркуляції (трентал, грізеофульфін, андекалін, АТФ, гепарин, реополіглюкін).
3.Стимуляція тканинних процесів (лідаза, ронідаза, унітіол, димексид, аевіт, вітаміни групи В).
4.Антизапальна терапія (ацетилсаліцилова кислота, індометацин, фенілбутазон, бутадіон, преднізолон).
5.Антисклеротична терапія (Д-пеніцилламін, колхіцин, мадекасол, діуцифон).
6.Імунодепресанти (азатіоприн, хлорбутин, циклофосфан, меркаптопурин) та імуностимулятори (левамізол, антимоноцитарний глобулін).
7. Фізіотерапія, лікувальна фізкультура, масаж, тощо.
Вузликовий періартеріїт (хвороба Куссмауля-Мейєра). Характеризується системним некротизуючим ураженням переважно дрібних і середніх артерій м’язового типу. Захворювання зустрічається головним чином у чоловіків у віці 30-50 років.
Етіопатогенез до кінця не з’ясований. На думку більшості авторів різні ушкоджуючі фактори (інфекційні, хімічні, тощо) на фоні порушеного імунного гомеостазу приводять до важкої гіперергічної реакції, насамперед в судинах.
Порушення імунітету, переважно клітинного, втрата толерантності до власних клітин є визначаючим в розвитку складних патологічних процесів, в тому числі і автоімунних. В прогресуючій картині системного ураження судин визначна роль надається надлишковому утворенню імунних комплексів та порушенню їх елімінації. Ушкодження судин при вузликовому періартеріїті має сегментарний характер – змінені ділянки чергуються з інтактними. Це обумовлює утворення рископодібних потовщень (вузликів) по ходу уражених артерій. Слід зауважити, що для всіх шарів стінки артерій (панартеріїт) характерна наявність некротичних змін. Спочатку це фіброїдні зміни, набухання внутрішньої оболонки, потім інфільтрація лімфоцитами і плазмоцитами з подальшим склерозом.
Є.М.Тареєв поділив артеріїт на первинний і вторинний. До первинного відноситься: класичний, ювенільний, медикаментозний, симптоматичний (наприклад, трихінельозний), стероїдний (наприклад, при лікуванні глікокортикоїдами ревматоїдного артриту), нефрогенний (уремічний). За перебігом вузликовий артеріїт може бути гострий і хронічний.
Клініка складається із загальних симптомів (зростаюча слабкість, швидке схуднення, гарячка, пітливість, артралгія, міалгія, нейтрофільний лейкоцитоз, еозинофілія, гематурія та злоякісна артеріальна гіперемія (гломерулонефрит, нефросклероз); біль в ділянці серця, тахікардія (коронаріїти); порушення чутливості та рухової діяльності (ЦНС); абдомінальний синдром, тощо.
Принципи терапії. Ефективність лікування вузликового периартеріїта залежить від того, чи є це процес первинний, чи має місце вторинний симптоматичний періартеріїт. Проте, в лікуванні як первинного так і вторинного головним є проведення глюкокортикоїдної і імунодепресивної терапії в поєднанні з симптоматичною терапією (діуретики, гіпотензивні, знеболюючі та седативні препарати)
Дерматоміозит – системне захворювання, що характеризується переважним ураженням поперечносмугастих м’язів та шкіри. У випадку, коли шкірні зміни відсутні мова йде про поліміозит (хвороба Вагнера). Захворювання може виникнути в будь-якому віці, проте найчастіше спостерігається після 40 років переважно у жінок. В дитячому віці дерматоміозит є найбільш частою хворобою серед всіх колагенозів, а в похилому – є вторинним процесом, що виникає на фоні злоякісного новоутворення. Запропонована наступна класифікація дерматоміозиту:
І – поліміозит у дорослих
ІІ – типовий дерматоміозит
ІІІ – запальний міозит, асоційований з пухлиною
IV – міозит у дітей
V – міозит, поєднаний з іншими хворобами сполучної тканини.
Етіопатогенез. Вважають, що дерматоміозит виникає як своєрідна реакція сенсибілізованого організму на дію різних патогенних чинників: інфекції, пухлинний ріст, глистну інвазію, дію лікарських речовин, ультрафіолетового випромінювання, інсоляції, вакцинації, тощо. Реакція розгортається на тлі розладів регуляторних механізмів імунітету (знижується рівень Т-лімфоцитів), що призводять до активації ефективної ланки гуморального імунітету з посиленим синтезом імуноглобулінів. Імунопатологічні зрушення супроводжуються надлишком антитіл і циркулюючих імунокомплексів. Останні частково відкладаються в м’язах, що призводить до розвитку імунокомплексного запалення. Ці комплекси взаємодіють також з Fc-рецепторами лімфоцитів, посилюючи порушення імунної відповіді, що викликає гіперсинтез імуноглобулінів з утворенням нових циркулюючих імуноглобулінів (вадове коло), які взаємодіючи з лімфоцитами призводять до посиленого вивільнення лімфокінів, для яких характерна міотоксична дія.
Клінічна картина. Ушкодження скелетних м’язів – визначаючий симптом захворювання. Слід відмітити, що наростає м’язова слабкість переважно проксимальних груп м’язів, в результаті чого різко обмежується рухова активність хворих.
У разі прогресування хвороби можлива повна нерухомість. Часто характерні такі симптоми як двоїння в очах (диплопія), опускання верхніх вік (птоз), порушення голосу (дистонія) і мови (дизартрія).
Шкірний синдром, в основному, характеризується еритемою на відкритих частинах тіла або над суглобами, параорбітальним набряком і еритемою верхнього віка. Ураження внутрішніх органів зустрічається рідко.
Принципи лікування. Вибір терапевтичних заходів при дерматоміозиті залежить від характеру перебігання (гострий, підгострий або хронічний), а також від активності процесу. На перший план виступає протизапальна терапія (глюкокортикостероїди, за виключенням тріамцінолона і дексаметазона, які можуть посилювати м’язову слабкість). При високих показниках активності процесу до лікування підключають імунодепресанти (азатіоприн, метотрексат, циклофосфан). Як допоміжне загальнозміцнююче лікування при дерматоміозиті призначають вітаміни групи В, кокарбоксилазу, АТФ, а також анаболічні гормони (метандростенолон, метиландростендіол та ін.)
У разі кальцинозу, що супроводжує дерматоміозит, показана динатрієва сіль етилендіамінтетраоцтової кислоти (Na2 ЕДТА), яка утворює комплексні сполуки з іонами кальцію.
Масаж і фізіотерапевтичне лікування (електрофорез з гіалуронідазою, теплові процедури) застосовують при хронічній формі захворювання.
Системний червоний вовчак. Це багатосистемне захворювання сполучної тканини, яке характеризується наявністю численних автоантитіл, циркулюючих імунокомплексів з великомасштабним ураженням тканин.
Системний червоний вовчак частіше зустрічається в США та на Далекому Сході. За частотою захворювання здебільшого спостерігається у віці 20-30 років. Співвідношення хворих жінок і чоловіків становить 9:1. Поширення його в Європейській популяції – 30-40 на 100 000.
Етіопатогенез. Хоча причина виникнення червоного вовчака все ще не зовсім зрозуміла, сучасні концепції ґрунтуються на тому, що ця хвороба являє собою порушення, на виникнення якого впливають багато факторів і під час якого відбувається сильний розлад імунного регулювання.
Свідчення впливу генетичних факторів на етіологію хвороби такі:
Випадкові виникнення хвороби у монозиготних близнюків.
Більша, ніж звичайно, частота виникнення системного червоного вовчака, інших захворювань сполучної тканини, антинуклеарних антитіл та імунних комплексів у членів сім’ї хворого.
Успадкований дефіцит окремих компонентів комплемента, наприклад, С2 у деяких пацієнтів.
Підвищена частота виникнення антигенів гістосумісності гаплотипів В8 та DR3 головного комплексу гістосумісності.
Свідчення впливу факторів навколишнього середовища включають:
Провокуючий вплив сонячного випромінювання (фотосенсибілізація), інсоляція, курортне та фізіотерапевтичне лікування, оперативні втручання.
Внаслідок вживання лікарських препаратів (гідрофталазин, новокаїнамід, сульфаніламід, антибіотики).
Значення естрогенів як детермінант прояву хвороби. Її загострення часто спостерігається під час вагітності, з початком менструації, після аборту, тощо.
Існують свідчення вірусного інфікування тварини системним червоним вовчаком, однак даних про вірусне інфікування людей цією хворобою немає.
Імунологічно опосередковане ушкодження тканин виникає внаслідок щонайменше двох механізмів розвитку системного червоного вовчака:
Безпосередня цитотоксичність, що опосередкована антитілами до компонентів ядра і ДНК (реакції гіперчутливості ІІ типу). Наприклад, ураження мозку та аборт можуть бути результатами цитотоксичності холодових токсичних антитіл, які дають перехресну реакцію з нервовою або трофобластною тканинами.
Підвищена чутливість, опосередкована імунним комплексом та комплементом (реакції гіперчутливості ІІІ типу). Вважають, що ці реакції і складають основу патогенезу червоного системного вовчака.
Причина утворення антитіл – зниження толерантності до власних антигенів (неефективна толерантність, порушення впізнавання антигенів), дефект Т-системи (зниження активності Т-супресорів) і В-системи (поліклональна активація).
Потрібно відмітити (що тривалий час) основне патогенетичне значення відводилось системі ДНК – антитіла до ДНК. Проте, як антигени розглядаються і нуклеосоми (комплекс ДНК-гістом). Вивільнення нуклеосом із клітин зв’язують з порушення апоптозу (програмована смерть клітин), що може викликати експансію автореактивних клонів Т- і В-клітин та утворення антитіл до нуклеосом у генетично чутливих індивідуумів.
Антитіла, що взаємодіють з ДНК, РНК та цитоплазматичними антитілами, утворюють імунні комплекси, які накопичуються у стінках дрібних судин, базальній мембрані та активують елементи системи комплементу С3 та С4 класичним шляхом. При системному червоному вовчаку можуть утворюватися антитіла проти факторів згортання крові (особливо VII) та антигенів клітин крові. До патологічного процесу також залучаються нейтрофіли, які фагоцитують ядра загиблих клітин. Ушкодження тканин при системному червоному вовчаку характеризується гострим та хронічним запаленням, накопиченням фібриноїдного матеріалу у судинній стінці, мононуклеарною інфільтрацією, проліферацією фібробластів та зменшенням популяції Т-клітин.
Клінічна картина: артрит (тимчасовий та мігруючий), артралгія та гарячка; ушкодження шкіри проявляється класичним чутливим до світла висипом у формі «метелика» (рис. 6.6) на обличчі; серцево-легеневі ураження: перикардит, міокардит, поліпозний ендокардит Лібмана-Сакса, ексудативний плеврит, фіброзний альвеоліт і гострий люпозний пневмоніт; ураження нирок: нефротичний синдром і хронічна ниркова недостатність; ураження ЦНС: епілепсія, іноді сильна депресія, гемі- та параплегії, хорея. Ушкодження системи травлення обумовлено васкулітом судин органів черевної порожнини і проявляється анорексією, нудотою, діареєю та абдомінальними болями.
Принципи
терапії.
При гострих
і підгострих формах системного червоного
вовчака лікування потрібно проводити
в умовах стаціонару. Їжа повинна бути
висококалорійною, містити в собі
збільшену кількість білка (120 - 150 г на
добу) і вітамінів, а також обмеження
кухонної солі (3 – 5 г на добу).
Рис. 6.6. Висип на шкірі у формі «метелика» при системному червоному вовчаку
Основний метод терапії полягає в застосуванні кортикостероїдів, в основному, преднізолону. Іноді виникає потреба в «пульсуючій терапії» із застосуванням метилпреднізолону при лікуванні пацієнтів, які страждають проліферуючим гломерулонефритом, а також і нирковою недостатністю. З початком ремісії необхідно робити обережні спроби припинення введення стероїдів або введення їх дуже низьких доз через день.
Суглобові симптоми та незначні прояви запальних процесів необхідно лікувати нестероїдними препаратами (диклофенак, анальгін, індометацин, ібупрофен).
Імунопригнічуючі препарати застосовуються щодо хворих із сильно вираженим дифузним проліферативним гломерулонефритом, у яких не вдається викликати відповідну реакцію на лікування кортикостероїдами, а також щодо тих пацієнтів, які потребують настільки високих доз терапії стероїдами, що вони можуть викликати сильні побічні ефекти.
Слід відмітити, що останнім часом широко застосовується екстракорпоральне очищення крові – гемосорбція і плазмафорез, що дозволяє суттєво знизити в крові вміст циркулюючих імунокомплексів, автоантитіл, компонентів комплемента, тощо.
Таким чином, від важкості протікання показань та протипоказань медикаментозна терапія системних хвороб сполучної тканини припускає послідовне застосування нестероїдних протизапальних препаратів, глюкокортикостероїдів та імуносупресантів.
