- •Гоу впо «московский государственный медико-стоматологический университет федерального агенства по здравоохранению и социальному развитию»
- •Тема 3. Барьерные функции организма и их нарушения 18
- •Тема 4. Патофизиология острого повреждения клетки
- •Тема 5. Острое воспаление ........25
- •Тема 6. Нарушение течения раневого процесса .......31
- •Тема 11. Гипоксия 50
- •Часть II. Частная патофизиология 53
- •Тема 12. Патофизиология системы крови 53
- •Тема 13. Патофизиология свертывающей системы крови gj
- •Тема 14. Патофизиология внешнего и тканевого дыхания 68
- •Тема 15. Недостаточность сердца и нарушение электрогенеза миокарда 73
- •Тема 16. Патофизиология желудочно-кишечного тракта 85
- •Тема 17. Патофизиология печени 8?
- •Часть I. Общая патофизиология
- •Тема 1. Моделирование болезней и патологических процессов
- •Тема 2. Патологическая физиология периферического кровообращения
- •Занятие 1. Артериальная и венозная гиперемия
- •Тема 3. Барьерные функции организма и их нарушения
- •Внутренние (гистогематические) барьеры (ггб)
- •Тема 4. Патофизиология острого повреждения клетки
- •Тема 5. Острое воспаление
- •Особенности воспалительных процессов в челюстно-лицевой области
- •Воспаление пульпы зуба (пульпит)
- •Занятие 1. Сосудистые изменения при воспалении
- •Занятие 2. Нарушение обмена веществ и механизмы защиты при воспалении
- •Тема 6. Нарушение течения раневого процесса
- •Занятие. Нарушение заживления кожной раны
- •Тема 7. Аллергия
- •Занятие 1. Патогенез аллергии немедленного типа
- •Тема 8. Патофизиология злокачественного роста
- •Тема 9. Лихорадка
- •Тема 10. Патофизиология водного обмена. Отек
- •Занятие. Патогенез отеков
- •Тема 11. Гипоксия
- •Занятие. Патогенез гипоксической гипоксии
- •Часть II. Частная патофизиология
- •Тема 12. Патофизиология системы
- •Класс морфологически дифференцированных клеток гранулопоэза
- •Плазматические клетки
- •Периферическая кровь при гиперхромных анемиях
- •Костный мозг при гиперхромных анемиях
- •Содержание гемоглобина (в процентах по Сали) / удвоенные две цифры числа эритроцитов
- •Тема 13. Патофизиология свертывающей системы крови
- •Воспроизведение механической желтухи
- •Опыт I. Определение времени рекальцификации плазмы
- •Тема 14. Патофизиология внешнего и тканевого дыхания
- •Тема 15. Недостаточность сердца и нарушение электрогенеза
- •Миокарда
- •Занятие 1. Экспериментальная недостаточность сердца
- •Занятие 3. Патология сердечного ритма
- •Изучение типических электрокардиограмм
- •Нарушение автоматизма
- •Нарушение возбудимости
- •Нарушение проводимости
- •Мерцание и трепетание предсердий
- •Желудочковым комплексом)
- •Тема 16. Патофизиология желудочно-кишечного тракта
- •Занятие. Патогенез острого гастрита
- •Занятие 2. Патогенез острого энтерита
- •Тема 17. Патофизиология печени
- •Занятие. Нарушения функции печени при экспериментальном гепатите. Патогенное действие желчи
- •Тема 18. Патофизиология почек
- •Тема 19.Патофизиология нервной системы
- •Тема 20. Патофизиология зубочелюстной системы. Патология пародонта
- •Занятие. Экспериментальный пародонтоз
- •Тема 21. Клеточные механизмы антимикробной защиты полости рта
- •Тема 22.Патофизиология эндокринной
При
разлитых одонтогенных воспалительных
процессах возможны глубокие изменения
системы гемостаза; гилокоагуляция,
обусловленная активацией фибринолитической
системы и недостаточностью прокоагулянтов,
или чаще гиперкоагуляция, вплоть до
развития синдрома диссеминированного
внутрисосудистого свертывания крови.
Занятие
1. ЭКСПЕРИМЕНТАЛЬНОЕ ВОСПРОИЗВЕДЕНИЕ
НАРУШЕНИЙ СВЕРТЫВАЮЩЕЙ СИСТЕМЫ КРОВИ.
РОЛЬ РОТОВОЙ ЖИДКОСТИ В ГЕМОСТАЗЕ
Цель
занятия; изучить
механизмы изменений системы гемостаза
при
механической
желтухе
и повреждении
стенки сосуда,
влияние ротовой
жидкости на гемостаз
Рис.
16
Фотографии
сгустков фибрина, полученные с помощью
растрового электронного микроскопа.
/5
- растворимый фибрин, /.- нерастворимый
фибрин, структуированная фибринная
сеть.
В
опытах № 1,2
и
3 будут исследованы показатели
свертывающей и фибринолитической
систем крови у кроликов с механической
желтухой.
За
18 дней до занятия кролику под гексеналовым
наркозом производят операцию перевязки
общего желчного протока. Для исследования
берут 4,5 мл крови из краевой вены уха
кролика в пробирку, в которую предварительно
вносят 0,5 мл 1,34%
раствора оксалата натрия. Аналогично
берут кровь в пробирку у контрольного
кролика. Пробирки с кровью центрифугируют
в течении 10 мин при 2000 об/мин, затем
плазму отсасывают и переносят в другие
пробирки для исследований.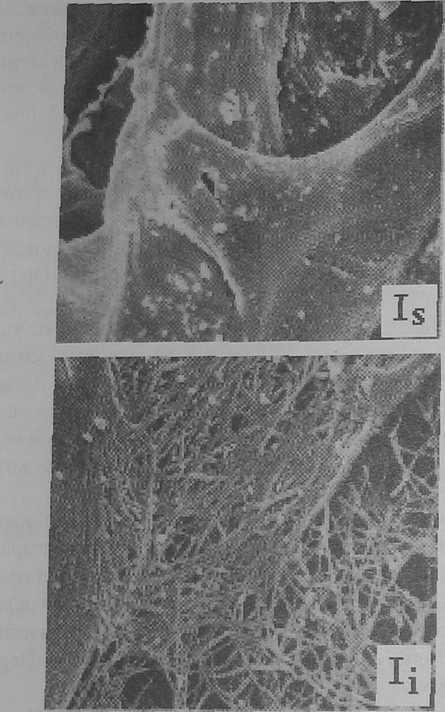
Воспроизведение механической желтухи
Время
рекальцификации плазмы - это время, в
течение которого образуется фибрин в
оксалатной плазме после добавления
к ней хлористого кальция.
В
пробирку вносят 0,2 мл 0,28% раствора
хлористого кальция и добавляют 0,1
мл
физиологического раствора. Смесь
выдерживают в течении 60 сек на водяной
бане при 37о С, затем добавляют к ней
0,1 мл оксалатной плазмы контрольного
кролика.
Одновременно
включают секундомер. Отмечают время
появления хлопьев фибрина (начало
образования сгустка), т. е. время
рекальцификации плазмы. Аналогичное
определение проводят с плазмой
подопытного кролика.
Полученные
результаты сравнивают и отмечают
увеличение времени рекальцификации
плазмы кролика с механической желтухой.
В
норме время рекальцификации плазмы
кролика составляет 1-2 мин и по своему
значению эквивалентно времени свертывания
крови.
Опыт
2.
Определение
протромбинового времени и расчет
протромбинового индекса
Исследование
протромбинового времени позволяет
определить не только активность
протромбина в крови, но также
активность ускорителей превращения
протромбина в тромбин, т. е. факторов
V, VI, VII. Методы косвенного определения
активности протромбинового времени
основаны на том, что тромбин под влиянием
тромбооластина в присутствии солей
кальция превращается в тромбин,
вызывающий образование фибрина (в виде
сгустка).
Для
исследования в пробирку, находящуюся
на водяной бане, вносят 0,1 мл оксалатной
плазмы контрольного кролика и 0,1 мл
раствора тромбопластина. Через 30 мин
прибавляют 0,1 мл 0,55% раствора хлористого
кальция и одновременно пускают
секундомер. При медленном покачивании
пробирки отмечают время появления
фибрина - протромбиновое время. Затем
определяют протромбиновое время
плазмы кролика с механической желтухой.
Результаты
сравнивают и отмечают увеличение
протромбинового времени у опытного
кролика. Между временем появления
сгустка фибрина и активностью протромбина
существует обратно пропорциональная
зависимость: чем меньше протромбиновое
время, тем больше активность
протромбина. Протромбиновый индекс
определяется по формуле:
протромбиновое
время (контроль)
х
100%
протромбиновое
время (опыт)
В
норме протромбиновый индекс составляет
80-100%. Его снижение наблюдается при всех
заболеваниях,
сопровождающихся нарушением
синтеза протромбина, проакцелерина,
прокон-вертина, при выраженной
гипофибриногенемии, а также
гипергепаринемии.
Анализируют
полученные данные, делают выводы.
Опыт
3. Изучение коагулограммы крови у
кроликов с механической желтухой
Коагулограмма
- графическое изображение процессов
свертывания крови и фибринолиза,
основанное на изменении её электропроводности
в зависимости от агрегатного состояния.
Исследование проводят на коагулографе
типа Н-334.
У
контрольного и подопытного
животного из краевой
вены уха непосредственно перед записью
коагулограммы берут кровь.
Во
фторопластовую ячейку прибора вносят
0,28 мл исследуемой крови (до метки),
ячейку закрывают крышкой, устанавливают
в держателе термостата прибора, включают
запись измерения электропроводности
крови. При помощи специального устройства
ячейка совершает качатель-ные движения,
в результате чего кровь попеременно
то замыкает, то размыкает электроды,
скатываясь с них. По мере свертывания
кровь стекает с электродов все медленнее
и при окончании процесса свертывания
электроды прекращают размыкаться. В
зависимости от плотности сгустка
толщина слоя над электродами будет
меняться, что приводит к уменьшению
сопротивления. Результаты исследования
записываются как последовательные
импульсы с частотой 6 раз в мин.
(Рис.
17- 18).Опыт I. Определение времени рекальцификации плазмы
На
коагулограмме определяют следующие
параметры:
1. Начало
свертывания крови — Т,, (мин, сек) - путем
подсчета числа делений на диаграм-
мной
бумаге от начала записи до первого
импульса с уменьшенной амплитудой.
Одно деление
на
бумаге соответствует J
мин, а 1 импульс - 10 сек.
Конец
свертывания крови — Т2
(мин, сек) - путем подсчета числа делений
на диаграмной бумаге от начала записи
до первого импульса с минимальной
амплитудой.
Плотность
сгустка - Ао
- по амплитуде импульсов (мм) в конце
свертывания крови.
Начало
ретракции и фибринолиза (Т3)
измеряют от начала свертывания до
первой увеличенной амплитуды после
минимальной (мин, сек).
Суммарную
величину фибринолиза и ретракции (Ам)
- по амплитуде импульса (мм)
через
10
мин
после окончания свертывания крови.
Рассчитывают
условную скорость фибринолиза и
ретракции по формуле:
V—
Ам—Ао/1 (мм/мин),
при
t
= 10
мин после окончания свертывания.
Полученные результаты сравнивают,
отмечают увеличение времени свертывания
крови и активацию фибринолиза у кролика
с механической
желтухой.
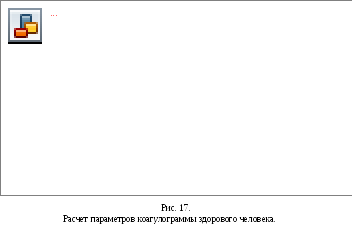
Рис.
18. Типовые коагулограммы A
— норма; Б — замедление свертывания;
В — ускорение свертывания.
Опыт
4.
Образование
пристеночного белого тромба при
повреждении сосудистой стенки
Лягушку,
обездвиженную разрушением спинного
мозга, помещают на дощечке брюшком
вверх. Ножницами делают разрез кожи и
мышц на правом боку соответственно
месту расположения круглого отверстия
на дощечке. Затем пинцетом осторожно
захватывают петлю кишечника и
растягивают брыжейку над круглым
отверстием дощечки, укрепляя ее
булавками, которые вкалывают в стенку
кишечника. Необходимо следить, чтобы
петля кишечника не была перекручена,
а брыжейка сильно растянута во избежание
нарушения кровообращения.
Рис.
19.
Пристеночный
белый тромб [1].
Опыт
5.
Диссеминированное
внутрисосудистое свертывание крови
Лягушку
обездвиживают разрушением спинного
мозга, помещают на дощечку брюшком
вверх. Ножницами вскрывают грудную
клетку и брюшную полость. Растягивают
над круглым отверстием дощечки брыжейку
тонкого кишечника, фиксируя кишку
булавками, как в преды-