
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
1.2.2. Разработка плана синтеза
Каждое лекарственное средство может быть синтезировано несколькими альтернативными методами с использованием различных видов исходных продуктов (сырья). Появление новых видов полупродуктов, реакций и технологических процессов может резко изменить метод получения даже известных препаратов. Поэтому необходимо наработать практику составления плана синтеза БАВ на основе знания теории прохождения химических процессов органического синтеза, его конкретных условий и особенностей технологического оформления.
При разработке плана синтеза имеются два основных подхода – синтетический и ретросинтетический. Первый предполагает обычный подход: исходя из известных видов сырья, наметить последовательность реакций. Вторым методом разработки альтернативных путей получения БАВ является ретросинтетический подход к планированию синтеза. Прежде всего для его освоения необходимо привести терминологию:
Этот знак трансформация – мысленная операция расчленения молекулы при ретросинтетическом анализе, противоположная знаку реакции.
После расчленения молекулы на части возникают заряженные осколки Х+ Y¯ - синтоны.
Частицам Х+ и Y¯ необходимо подобрать реальное химическое соединение, в котором будут либо те же заряды, либо +, ¯ - синтетические эквиваленты. Синтетический эквивалент – реальное химическое соединение, позволяющее ввести синтон в молекулу в процессе ее конструирования.
БАВ – целевое соединение.
Далее, при трансформации необходимо расставить заряды синтонов так, чтобы отрицательный заряд находился на атоме, имеющем более высокую электроотрицательность, а положительный на менее электроотрицательном. В качестве примера можно рассмотреть ретросинтетический анализ молекулы парацетамола.

При трансформации молекулы разрываем связь С-N. Отрицательный заряд остается на группе NH, а положительный – на ацетильной группе. Соответственно синтетическими эквивалентами будут п-аминофенол и уксусный ангидрид или хлористый ацетил. Синтетический подход к разработке плана синтеза показан на схеме. Технический п-аминофенол не годится для получения парацетамола, т. к. содержит до 5 % продуктов окисления и других примесей, а очистка экономически невыгодна. Для синтеза препарата необходимо использовать свежеприготовленный продукт. Он может быть получен восстановлением п-нитрозофенола или п-нитрофенола. Пока в промышленности используют восстановление п-нитрофенола (причины этого рассмотрены в разделе «Реакции нитрозирования»).
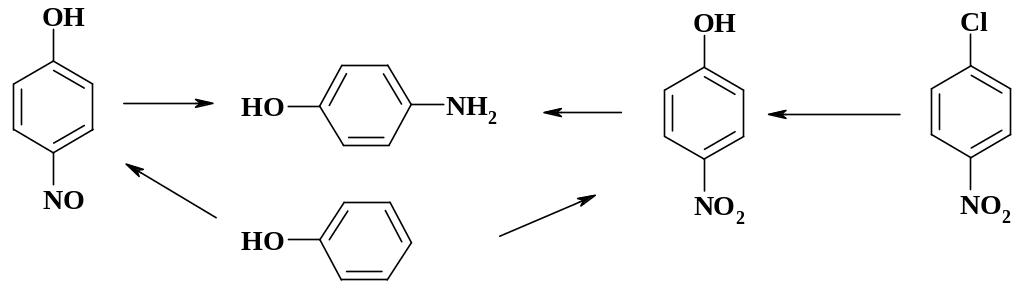
В свою очередь п-нитрофенол может быть синтезирован нитрованием фенола или гидролизом п-нитрохлорбензола. В случае нитрования фенола возникают технологические трудности из-за энергичного протекания реакции нитрования, сопровождающегося некоторым осмолением реакционной массы. Кроме того, велики энергозатраты на разделение о- и п-изомеров. Таким образом, наиболее рационально получать п-нитрофенол гидролизом нитрохлорбензола, который является промышленно производимым продуктом. Даже на этом простейшем примере видно, что для ретросинтетического анализа необходимо уверенное знание органических реакций, их механизма, представления об источниках сырья и его доступности. Возможности разработки технологии производства обусловлены условиями проведения реакций, аппаратурным оформлением процессов, вопросами максимального использования сырья, а также вопросами экономики и экологии.
После составления альтернативных планов получения препарата разрабатывают оптимальный метод промышленного синтеза (ОМПС). Разработка ОМПС требует учета следующих факторов:
минимальное количество стадий. Каждая стадия – это затраты времени и сырья, увеличение количества отходов. Синтез должен быть по возможности коротким. Желательно использовать реакции, которые осуществляются в одну стадию или, по крайней мере, не требуют выделения промежуточных продуктов;
выход на каждой стадии. В идеале выход должен быть количественным (реально – очень редко), но хотя бы максимально возможным. Желательно, чтобы выделение продукта было простым и доступным;
хемоселективность реакции. С практической точки зрения имеет исключительное значение проведение реакции по одному из нескольких реакционных центров исходного соединения (региоселективность) или получение одного из возможных стереоизомеров (стереоселективность). Учет этого требования помогает избежать кропотливой работы по разделению изомеров и уменьшает количество отходов производства;
условия реакции. Превращение должно протекать в легкодостижимых условиях и не должно сопровождаться использованием или выделением высокопожаро-, взрывоопасных либо токсичных веществ;
процесс не должен ни при каких условиях привести к экологической катастрофе;
побочные продукты процесса должны быть легко удаляемыми и в идеале должны быть используемы либо легко подвергаться обезвреживанию.
В реальных условиях производства сложность заключается в том, что учет всех этих факторов приводит к противоречивым результатам, и ОМПС становится неоднозначным. Технолог длжен отдать предпочтение тем методам, которые дают максимальный экономический эффект, но без ущерба экологии.
