
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.1.2.3. Особенности структуры и свойств нитрозосоединений
Алифатические продукты выделяют, как правило, в виде оксимов, таутомерных нитрозосоединениям. Для ароматических нитрозофенолов также возможно таутомерное равновесие между нитрозосоединением и оксимом. В случае п-нитрозодиметиланилина, как показывают квантово-химические расчеты, связи C-N имеют порядок, близкий к двойной. Этим объясняется превращение его в щелочной среде в п-нитрозофенол:

В присутствии кислоты образующийся нитрозофенол может вступать в реакцию конденсации с исходным фенолом, давая краситель индофенол. Поэтому технический п-аминофенол, полученный восстановлением нитрозофенола, имеет синеватый оттенок.

Тем не менее использование реакции нитрозирования для получения аминопроизводных имеет большое значение. Региоселективность процесса, легкость восстановления нитрозогруппы, низкая экологическая нагрузка и мягкие условия проведения реакции дают большие преимущества этого метода по сравнению с нитрованием.
2.1.2.4. Практика проведения реакции нитрозирования
Для проведения реакции необходимо добиваться максимальной гомогенизации реагентов. Возможно механическое измельчение субстрата реакции, но лучше использовать его химическое осаждение с получением мелкодисперсного осадка.
Аппаратурное оформление процесса. Тепловой эффект реакции, в отличие от нитрования, невелик, поэтому процесс ведут в емкостном аппарате с рубашкой для охлаждения водой. При использовании разбавленной соляной кислоты необходимо выбирать стальной или чугунный эмалированный аппарат. Мерник для загрузки соляной кислоты также должен быть эмалированным. При малой мощности производства он может быть стеклянным или из поливинилхлорида. Вязкость реакционной массы высокая, т. к. нитрозосоединения обычно выпадают в осадок. Поэтому для перемешивания используют якорную мешалку. Раствор нитрита натрия при нитрозировании аминов готовят в отдельном аппарате. Основной аппарат соединяют с линией поглощения оксидов азота, их отсос осуществляют с помощью вакуума.
Порядок смешения реагентов. В промышленном синтезе нитрозосоединений используют два метода смешения реагентов. Первый применяют при нитрозировании фенолов, пиразолона и СН-кислот. Сущность данного способа заключается в том, что субстрат реакции и нитрит натрия растворяют в щелочи, к полученному раствору или суспензии приливают из мерника раствор соляной кислоты до рН 1 – 2 и поддерживают это значение рН в течение всего процесса.
В качестве примера следует рассмотреть нитрозирование 1,3-диметил-4-аминоурацила, являющегося скрытой СН-кислотой.
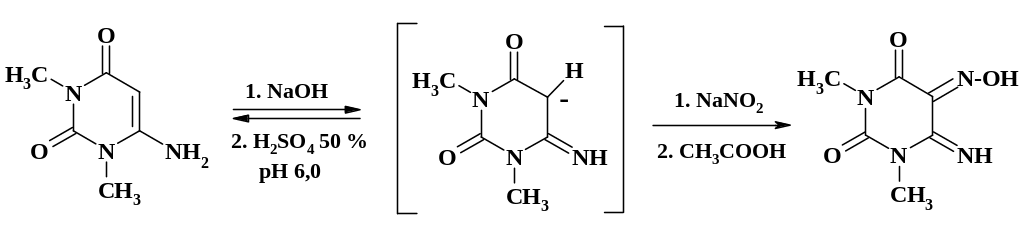
Аминоурацил растворяют в щелочи, затем для получения мелкодисперсного осадка добавляют 50 % серную кислоту, доводят рН до 5,5 – 6 и прибавляют нитрит натрия. Нитрозирование проводят при величине рН 4 путем постепенного приливания из мерника уксусной кислоты. Выпавший нитрозоурацил отфильтровывают.
Второй способ используется при нитрозировании аминов. Производные анилина или гетероциклического амина растворяют в соляной или серной кислоте и из мерника приливают раствор нитрита натрия. Хотя в растворе имеется равновесие между основанием амина и аммониевой солью, в реакцию вступает только неионизированная форма. При проведении реакции нитрозоаминопроизводное выпадает в осадок в виде основания, т. к. в нем основность аминогруппы уменьшается. При нитрозировании моноалкиланилинов N-нитрозоаминосоединение обычно осаждается в виде осадка или масла, после чего водную фазу отделяют. Обрабатывают N-нитрозосоединение водным или спиртовым раствором кислоты, при нагревании происходит перегруппировка и образуется С-нитрозосоединение.
Только при использовании реакции Фишера-Хеппа удается ввести в ароматическое кольцо сразу две нитрозогруппы. При нитрозировании N,N`-ди-метил-м-фенилендиамина образуется N,N`-биснитрозопроизводное м-фени-лендиамина. Его выделяют и проводят перегруппировку. В результате этого удается синтезировать 4,6-биснитрозофенилен-1,3-ди-(N-метил)амин.

Температура проведения процесса, окончание реакции. Нитрозирование 1-фенил-2,3-диметилпиразолона-5, 8-гидроксихинолина, фенолов и диметиланилина проводят при температуре 20 – 30 оС. Нитрозирование производных аминоурацила ведут при температуре 50 – 60 оС. Конец процесса определяют по исчезновению в пробе реакционной массы исходных продуктов (ТСХ, ГЖХ).
Выделение и очистка нитрозосоединений. Практически во всех случаях нитрозосоединения выпадают в осадок, который отфильтровывают и без дополнительной очистки используют на следующей стадии. Перекристаллизацию не проводят, т. к. нитрозосоединения очень чувствительны к температуре и при попытке перекристаллизации осмоляются. Нитрозомочевины промывают на фильтре растворителем и сушат в глубоком вакууме.
