
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.2.3.1. Нуклеофильное замещение по типу sn1
Тип SN1 реакций подробно рассмотрен в разделе 2.4. При нагревании ароматических солей диазония в кислой среде в отсутствие восстановителей наблюдается образование фенолов. Лимитирующей стадией реакции является образование карбокатиона:
![]()
Изучение кинетики процесса показало, что общий порядок реакции первый. Кроме того, константа скорости реакции не изменяется при переходе от воды к D2O. С помощью этого превращения диазониевой группы на заключительной стадии синтеза получают препарат фенилэфрин (мезатон).
2.2.3.2. Ариновое замещение
Второй тип реакций является одним из видов замещения, но в качестве промежуточного продукта образуется дегидроарен (арин). Эта короткоживущая нейтральная частица возникает при действии сильных оснований на неактивированные галогенарилы. На первой стадии происходит отрыв протона в о-положении к галогену, а на второй отрыв атома галогена. В качестве сильного основания используют амид натрия в жидком аммиаке:

Легкость отрыва галогена уменьшается в следующем ряду: Br > Cl > F. В несимметричных ароматических производных реакция, как правило, приводит к получению смеси о- и м-изомеров. Их соотношение зависит в основном от характера заместителя: если он имеет отрицательный индуктивный эффект, то преимущественно образуется м-изомер. Так при реакции о-хлоранизола с амидом натрия в жидком аммиаке соотношение изомеров м-:о- составляет 95:5. В случае о-хлортолуола соотношение этих изомеров 45:55.
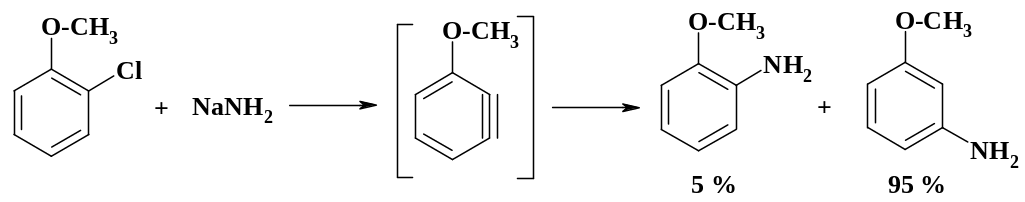
Ориентация нуклеофильного присоединения зависит также и от активности реагента. Чем выше его активность, тем меньше селективность. Помимо амида натрия в реакциях этого типа используют бутиллитий. Образование арина наблюдается и при разложении о-диазобензойной кислоты:

Проведение данной реакции в присутствии нуклеофила приводит к получению продукта присоединения этого нуклеофила.
2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
В данном разделе рассмотрен третий тип реакций – классический механизм присоединения – отщепления SNAr. Описываемые процессы имеют большое значение как в ароматическом ряду, так и в ряду азинов. Нуклеофил и субстрат образуют -комплекс, который превращается в -аддукт.

Анионные -аддукты, которые называют аддуктами Джексона – Мейзенгеймера, были выделены в твердом виде:
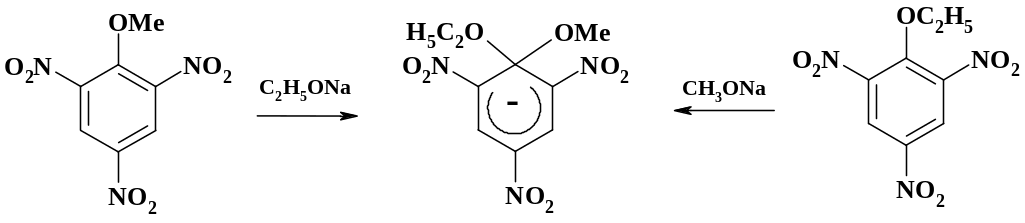
Они являются глубоко окрашенными веществами и подробно охарактеризованы с помощью ИК, УФ и ЯМР спектроскопии. По рентгеноструктурным данным все атомы углерода кольца и азота нитрогрупп лежат в одной плоскости, а метокси- и этоксигруппа – в плоскости, перпендикулярной кольцу.
Подробное изучение взаимодействия тринитроанизола с этоксид анионом показало, что быстро образуется термодинамически менее стабильный 3--аддукт (аддукт Сервиса) и медленнее более устойчивый 1--аддукт.

Наличие на координате реакции аддукта Сервиса объясняет аномалии нуклеофильного замещения, а также синтетические возможности, вытекающие из этого, которые будут рассмотрены в случаях нуклеофильного замещения водорода.
В реакциях, которые идут по обычному механизму SNAr, наиболее часто лимитирующей стадией является образование -аддукта. При этом наблюдаются следующие кинетические закономерности:
![]()
Тот факт, что разрыв связи не определяет скорости реакции при замещении атома галогена, подтверждается значительно большей скоростью замещения фтора по сравнению с хлором и бромом. Энергия связи C-F больше, чем связей C-Cl и C-Br, но заряд на атоме углерода, связанным с атомом фтора, выше. Поэтому замещение фтора идет легче. Анализ литературных данных позволил Баннету и Цалеру установить по легкости отщепления нуклеофугных групп следующую последовательность:
F > NO2 > Cl Br > I ; Cl > N3 > SO3R > N+R3 > OАr > OАlk > SR > SO2R
Этот ряд хорошо согласуется с константами скорости реакции нитропроизводных бензола с пиперидином. В качестве стандартного образца взят п-нитрохлорбензол (k = 6,610 –5 л моль-1 с-1, kотн = 1). Данные представлены в табл. 2.12:
Таблица 2.12

X |
kотн |
X |
kотн |
F |
412 |
O–C6H4NO2 |
2,9 |
Cl |
1 |
OCOCH3 |
0,06 |
Br |
1,17 |
OSO2C6H4CH3 |
5,5 |
I |
0,26 |
SO2Ph |
0.0088 |
NO2 |
8,7 |
SO2Ph-NO2 |
0,11 |
OCH3 |
0,0017 |
SPh |
0,001 |
OCH2Ph |
0,0011 |
SPh-NO2 |
1,15 |
OPh |
0,03 |
CN |
0,001 |
Изучение кинетики реакций показало, что реакционных серий изменяется в пределах от + 3,1 до + 6,6. Для протекания реакции необходимо наличие электроноакцепторных заместителей. С учетом этих фактов можно продемонстрировать условия замещения нуклеофугных групп на аминогруппу:

Схема иллюстрирует условия замещения. Согласованное действие электроноакцепторных нитрогрупп в пикрилхлориде приводит к тому, что реакция идет при комнатной температуре. Уменьшение числа нитрогрупп требует повышения температуры проведения процесса. Сравнение условий замещения в о-динитробензоле и о-хлорнитробензоле показывает, что нитрогруппа уходит легче. Замещение атома хлора в о-хлорбензойной кислоте в приемлемых технологических условиях не идет без катализатора (см. в данном разделе синтез мефенаминовой кислоты). Для этих каталитических процессов (реакция Ульмана) используют мелкодисперсную медь или соли меди, нанесенные на силикагель или пемзу.
Закономерности по реакционной способности уходящих групп другие. Так наблюдается следующая последовательность: I > Br > Cl > F. Поэтому в синтезе препарата трифтазин (получение 3-трифторметилдифениламина – раздел 2.3) в реакции нуклеофильного замещения в присутствии соли меди используют бромбензол с добавкой иодистого калия.
