
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.1.6.2. Реагенты, механизм реакций галогенирования
Галогенирование ароматических соединений относится к реакциям электрофильного замещения. В отличие от нитрования, нитрозирования и сульфирования, в этих процессах часто используются катализаторы.
Реагенты: Cl2, Br2, I2 (но не F2), ClF, IСl, HOCl, HOBr, ROCl, R-SO2NHCl, S2Cl2, SO2Cl2, а также галогены, образующиеся в результате следующих реакций:
2 H2SO4 + 2 NaBr = Br2 + Na2SO4 + 2 H2O + SO2
![]()
Катализаторы: FeCl3, I2, H2SO4, NH4Cl, TiCl4, SbCl5
Механизм реакции. Реакционноспособная частица Hal+, как считалось ранее, образуется в результате следующих превращений:
![]()
![]()
Но при более подробном изучении было найдено, что действительным реагентом в хлорировании является оксид хлора Cl-O-Cl, который возникает по реакции:
![]()
Гетеролитического разрыва связи между атомами хлора и брома с образованием ионов Cl+ и Br+ не происходит из-за высокой энергии активации этой реакции, и только в присутствии катализатора такой распад становится возможным. Так при взаимодействии ароматических соединений с галогенами в присутствии катализаторов происходят реакции, представленные на примере хлорирования бензола в присутствии хлорного железа:
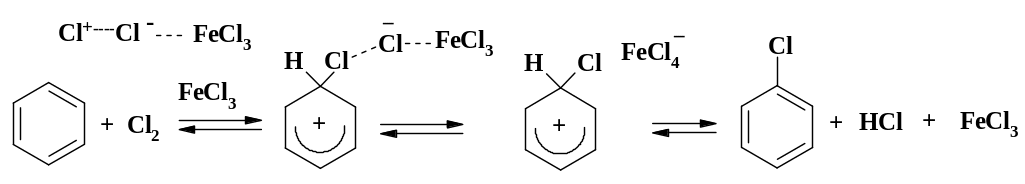
Реакции галогенирования, в отличие от нитрования и сульфирования, не имеют четкой стадийности при последующем замещении. Так для атома хлора п+ = + 0,11, а для нитрогруппы п+ = + 0,79. Из уравнения Гаммета следует, что скорость реакции получения м-динитробензола снижается в 50 000 раз по сравнению со скоростью получения нитробензола ( = - 6). В случае образования из хлорбензола дихлорбензола наблюдается снижение скорости реакции лишь в 7 – 8 раз ( = - 5…-12). Атом хлора обладает -I и +М эффектом. За счет индуктивного эффекта снижается электронная плотность в бензольном ядре.

Но мезомерный эффект приводит к стабилизации -аддукта при о- и п-атаке электрофильного агента за счет дополнительной делокализации положительного заряда и тем самым к снижению свободной энергии активации.
2.1.6.3. Хлорирование ароматических соединений
При хлорировании бензола избытком хлора наряду с хлорбензолом образуются дихлор- и полихлорбензолы. Изомерный состав полихлорбензолов, как видно из приведенной схемы, весьма разнообразен.

При действии активных кислот Льюиса изомеризация облегчается. Для получения индивидуальных соединений очень важен подбор катализатора.
Полихлорбензолы служат исходным сырьем в синтезе поли- и перфторпроизводных, которые являются интермедиатами при получении антибиотиков фторхинолонового ряда. Глубокое хлорирование смеси три- и тетрахлорбензолов при температуре 100 оС дает пента- и гексахлорбензол.
При обработке п-хлорфторбензола хлороводородом в присутствии хлорида алюминия образуется смесь изомерных продуктов:

В приведенном примере наблюдается смещение только атома хлора, но не фтора, т. к. энергия связи C-F существенно выше, чем связи C-Cl.
В тех случаях, когда необходимо предотвратить
образование полихлорпроизводных,
применяют такой технологический прием,
как обрыв реакции на начальных стадиях
процесса. Кинетические кривые приведены
на рис. 2.2.
тех случаях, когда необходимо предотвратить
образование полихлорпроизводных,
применяют такой технологический прием,
как обрыв реакции на начальных стадиях
процесса. Кинетические кривые приведены
на рис. 2.2.
Рис. 2.2. Кинетические кривые реакции хлорирования бензола:
1-кривая расхода бензола во времени от 100 % до 0 %; 2 - кривая образования
хлорбензола; 3 - кривая получения дихлорбензолов; 4 – обрыв реакции
Из рис. 2.2 видно, что с увеличением массы хлорбензола начинается образование дихлорбензолов, концентрация хлорбензола снижается. Для того чтобы уменьшить вероятность образования ди- и полихлорбензолов, необходимо оборвать реакцию на начальной стадии. Бензол остается неизрасходованным, примесь дихлорбензолов минимальна.
При хлорировании толуола образуется смесь приблизительно равных количеств о- и п-хлортолуолов с примесью дихлорпроизводных. При этом до 70 % толуола не хлорируется и остается в неизмененном виде. Изомеры разделяют дробной кристаллизацией. Исходным продуктом в синтезе мефенаминовой кислоты служит о-хлорбензойная кислота, которую синтезируют из о-хлортолуола.
Для синтеза лекарственных препаратов необходимо использовать индивидуальные соединения высокой чистоты. Поэтому 2,4-дихлортолуол, являющийся промежуточным продуктом в производстве аминазина, получают диазотированием 2,4-толуилендиамина и заменой диазониевых групп на хлор (см. раздел 2.4). Конечно, это соединение, синтезированное прямым хлорированием толуола, намного дешевле, однако содержит незначительные примеси других изомеров.

При наличии в ароматическом ядре электроноакцепторного заместителя региоселективность процесса увеличивается, т. к. общая скорость реакции хлорирования уменьшается.
В производстве гипотиазида используют м-хлоранилин, который получают из м-нитрохлорбензола. При хлорировании нитробензола образуется в основном м-нитрохлорбензол. Небольшая примесь м-дихлорбензола возникает в результате ипсо-замещения нитрогруппы.
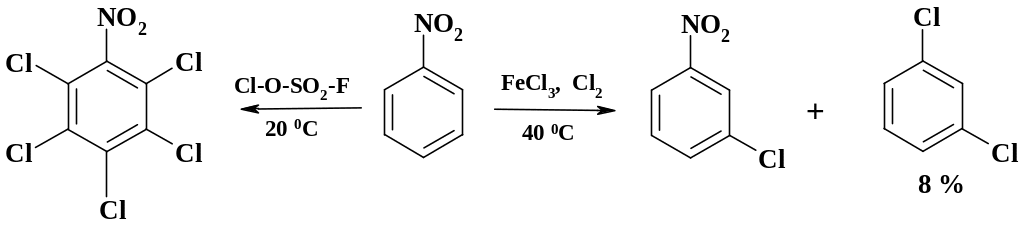
Хлорирование нитробензола одним из наиболее активных хлорирующих реагентов, каким является фторсульфонилгипохлорит, уже при 20 оС приводит к пентахлорнитробензолу. Тетрахлорфталевый ангидрид получают при пропускании хлора в раствор фталевого ангидрида в хлорсульфоновой кислоте при температуре 120 оС в течение 50 ч. В качестве катализатора в этом процессе используют иод.

В производстве гипотензивного препарата клонидин (клофелин) промежуточным продуктом является 2,6-дихлоранилин. При прямом хлорировании анилина образуется сложная смесь соединений. Поэтому для синтеза индивидуального 2,6-дихлоранилина блокируют п-положение анилина введением сульфогруппы, которая выполняет функцию защитной группировки.
При хлорировании сульфаниловой кислоты образуется только один продукт – 4-амино-3,5-дихлорбензолсульфокислота, 2,6-дихлоранилин получают с помощью десульфирования.

Вместо сульфаниловой кислоты в качестве исходного продукта может быть использован стрептоцид. Хлорирование в этом случае ведут в соляной кислоте с пероксидом водорода и также удаляют сульфогруппу.
В производстве гербицида 2,4-Д (2,4-дихлорфеноксиуксусной кислоты) хлорирование фенола проводят в присутствии воды. Процесс идет при низкой температуре без катализатора, в результате реакции образуется в основном 2,4-дихлорфенол с примесью 2,6-дихлор-, 2,4,6- и 2,4,5-трихлорфенолов.
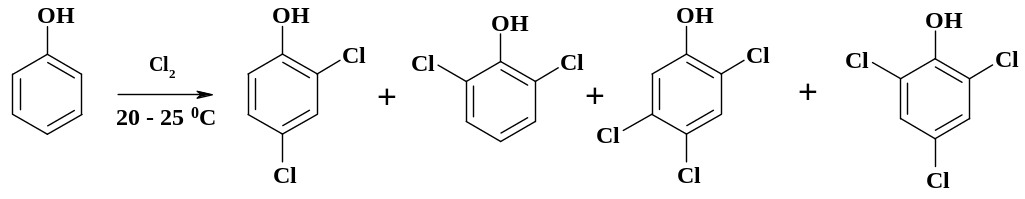
Целевой продукт отделяют ректификацией, кубовый остаток не находит квалифицированного применения. Однако в конечном продукте – 2,4-Д, содержится незначительное количество трихлорфеноксиуксусных кислот. При использовании этого гербицида на полях под действием ультрафиолета наблюдается его разложение. Из примесей, а также и при утилизации кубового остатка образуется диоксин:

Диоксин чрезвычайно токсичен, вызывает генетические мутации и злокачественные новообразования. Разлив полихлорфенолов может привести к экологической катастрофе. В настоящее время производство данного гербицида запрещено. Применение во время войны во Вьетнаме для борьбы с партизанами agent orange (гербицид сплошного действия, трихлорфеноксиуксусная кислота) привело к гибели джунглей на большой площади. Кроме того, среди военнослужащих США и мирного населения отмечена высокая смертность от онкологических заболеваний и рождение детей с наследственными уродствами.
Целенаправленный синтез 2,4,5-трихлорфенола осуществляют с помощью щелочного гидролиза 1,2,4,5-тетрахлорбензола, который очищают от непрореагировавшего тетрахлорбензола, 2,3,5-трихлорфенола и других примесей с помощью перекристаллизации из органических растворителей.
Исчерпывающее хлорирование фенола проводят вначале при температуре 60 – 70 оС в расплаве. При этом образуется 2,4,6-трихлорфенол. При дальнейшем хлорировании в смеси хлорсульфоновой и серной кислот образуется мягкий окислитель – хлоранил:

Хлорирование фенола в присутствии хлорного железа при 160 – 180 оС приводит к пентахлорфенолу. В настоящее время его производство из-за экологических последствий применения ограничено.
Для получения монохлорфенолов используют другие, более селективные реагенты. Хлорирование ведут хлористым сульфурилом с добавкой хлорного железа. Образуется смесь п- и о-хлорфенолов с преимущественным содержанием п-изомера. Индивидуальные продукты получают разгонкой.
Промышленностью в большом объеме выпускается хлорбензол, из которого получают 2-нитро-, 4-нитро- и 2,4-динитрохлорбензолы. Также выпускаются о- и п-хлортолуолы, использующиеся в синтезе соответствующих бензойных кислот и альдегидов. Производство хлорфенолов снижается. В меньшем объеме производят 2,6-дихлоранилин и 3-нитрохлорбензол.

В качестве растворителей и промежуточных продуктов в ряде производств находят применение о- и п-дихлорбензолы, которые образуются наряду с хлорбензолом.
Таким образом, для получения лекарственных соединений, где требуется высокая чистота продуктов, использование хлорирования на конечных стадиях производства нерационально в связи с низкой региоселективностью процесса.
