
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.1.5.4. Реакции аминоалкилирования
Механизм реакции аминоалкилирования является обычным для введения углеродных остатков в ароматический цикл. Образование карбокатиона происходит за счет присоединения амина к формальдегиду:
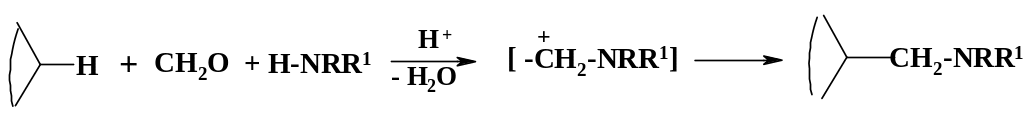
Подобно формальдегиду реагируют и другие алифатические и ароматические альдегиды. Помимо ароматических соединений в реакции вступают СН-кислоты и кетоны. К превращениям данного типа относятся реакции Манниха, Айнхорна и Бетти.
Препарат феникаберан обладает спазмолитическим, антиаритмическим действием, используется для лечения хронической коронарной недостаточности с приступами стенокардии. В синтезе данного лекарственного средства введение диметиламинометильной группы осуществляют с помощью реакции Манниха:

Синтез исходного гидроксибензоксазола приведен в разделе 2.7.
2.1.5.5. Реакции с-ацилирования
Одной из широко распространенных реакций электрофильного замещения в ряду ароматических соединений являются реакции С-ацилирования. При этом образуются арилкетоны. Реагентами служат те соединения, которые под действием катализатора могут генерировать ацильный карбокатион.
Реагенты. R-COCl, (RCO)2O, RCOOAlk, RCOOH, R-CN, Hal-CN. Реакционная способность тем выше, чем больше положительный заряд на атоме углерода:
R-COHal > (RCO)2O > RCOOAlk > RCOOH > RCONH2
В случае использования галогенангидридов наиболее активными являются бромангидриды кислот:
RCOF < RCOCl < RCOBr.
Катализаторы те же, что и при алкилировании, но в основном кислоты Льюиса. Для малореакционноспособных соединений применяют Al2Cl6, т. к. его реакционная способность высокая. Для высокореакционноспособных субстратов могут быть использованы ZnCl2, FeCl3.
Механизм реакции. В апротонных растворителях с помощью ИК и ЯМР спектроскопии было зафиксировано образование карбокатиона в виде тесной ионной пары:
![]()
Образование карбокатиона (иона ацилия) облегчено по сравнению с другими реакциями этого типа. Но его реакционная способность ниже, чем в случае применения Alk+ AlX4-. Электрофильная атака активированного реагента на ароматический цикл обычна для реакций электрофильного замещения:
![]()
Однако конечный продукт остается связанным с катализатором, разложение комплекса осуществляют с помощью добавления воды. Таким образом, катализатор не регенерируется. При использовании ангидридов, катализатор связывается и с кислотой. Поэтому необходимо использовать 1 или 2 – 2,5 мол катализатора. Кинетическое уравнение процесса имеет следующий вид:
V= Кобщ [ArH][R-COX][AlCl3] V= Кобщ [ArH][(R-COO)2O][AlCl3]2
В отличие от реакции алкилирования, чувствительность реакции к действию заместителей существенно выше, = -7…-9,5 (для алкилирования = -2.. -3), т. е. реакции С-ацилирования существенно более региоселективны. Кроме того, введение ацильной группы в ядро приводит к снижению реакционной способности полученного соединения по сравнению с исходным субстратом COR > 0. Так для COCH3 +n = + 0,5, m = + 0,38. Реакции имеют строгую стадийность, а также, в отличие от алкилирования, не наблюдается изомеризация алкильного остатка. Потому, при необходимости введения в молекулу целевого продукта алкильной группы, целесообразнее получить соответствующий кетон и затем восстановить его до алкильного производного.
Наиболее крупнотоннажным производством является получение антрахинона и большого ряда его производных (красителей). Реакцию с фталевым ангидридом ведут в избытке бензола, являющегося растворителем и реагентом. Если после окончания процесса проводят разложение реакционной массы водой, то получают 2-карбоксибензофенон (бензоилбензойную кислоту), нагревание которого в серной кислоте приводит к циклизации и образованию антрахинона. Повышение температуры после завершения первой стадии реакции ацилирования дает непосредственно антрахинон. Разработан также способ непрерывного проведения процесса в газовой фазе при 400 оС на гетерогенном катализаторе, в качестве которого используют силикат цинка. Полученные пары антрахинона и воды охлаждают и отделяют целевой продукт.

Реакцией фталевого ангидрида с гидрохиноном в плаве AlCl3 – NaCl при 170 оС получают 1,4-дигидроксиантрахинон – краситель хинизарин.

При использовании высокореакционноспособного субстрата ацилирования, каким является фенол, катализатором может служить хлорид цинка.
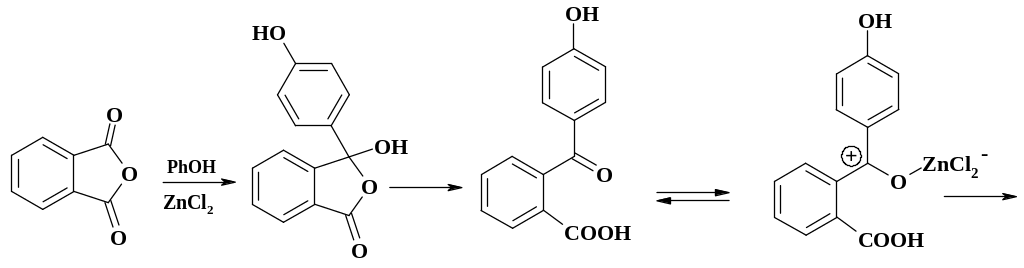

Реакция не останавливается на первой стадии. Полученный кетон также дает карбокатион и реагирует с фенолом. Образующийся триарилгидроксиметан дает лактон – бесцветную форму фенолфталеина (биологическую активность см. раздел 2.1.5). При добавлении щелочи лактонный цикл раскрывается и образуется хиноидная форма, имеющая в растворе красный цвет. При внесении в плав резорцина и фталевого ангидрида безводного хлорида цинка при температуре 105 оС происходит аналогичная реакция. При повышении температуры реакционной массы до 170 – 195 оС продукт дает ксантеновый цикл:

Натриевая соль полученного красителя флюоресцеина в водных растворах дает зеленую флюоресценцию при разбавлении 1:40 000 000. Это свойство используют для слежения за движением воды, для денатурации спирта и для ангиодиагностики. Тетрабромпроизводное – эозин – применяется в цитологии для окрашивания срезов биологических тканей. При проведении реакции фталевого ангидрида с м-диэтиламинофенолом получают ксантеновое производное – роданин, который служит пищевым красителем.
Промежуточным продуктом в производстве кристаллического фиолетового является кетон Михлера – 4,4΄-бисдиметиламинобензофенон. Это соединение получают из диметиланилина и фосгена:
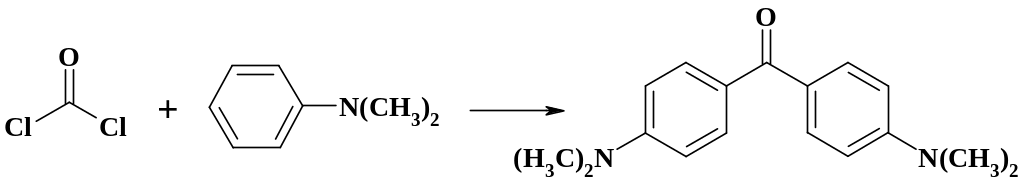
Модификациями ацилирования являются реакция Неницеску и перегруппировка Фриса. Метод Неницеску – ацилирование фенолов карбоновыми кислотами в присутствии хлорида цинка. Метод Фриса – перегруппировка О-ацильных эфиров фенолов в о- и п-ацилфенолы в присутствии хлорида алюминия, как это отражено на схеме.

Одним из продуктов, производимых промышленностью, является ацетофенон, который используют в качестве растворителя и промежуточного продукта, в частности при производстве фенилэфрина (мезатона). Это соединение является и побочным продуктом при многотоннажном производстве фенола из кумола (см. раздел 2.6).

Бензофенон, как уже отмечалось, получают из бензола и четыреххлористого углерода. Его синтез из бензола и бензоилхлорида или фосгена менее рентабелен. В производстве нейролептиков, таких как трифлуперидол, галоперидол (формула галоперидола приведена на схеме, типичный синтез на примере трифлуперидола приведен в разделе 2.2), трифлуспирилен и др. используют реакцию С-ацилирования. Большая группа нейролептиков является производными бутирофенона. На схеме представлен фрагмент синтеза одного из них – галоперидола:
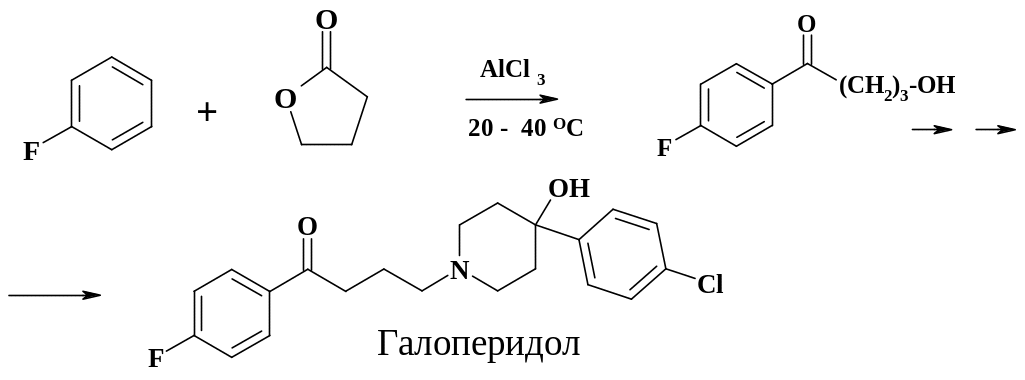
Ацилирование фторбензола хлорангидридом -хлормасляной кислоты или бутиролактоном дает п-фторфенил--гидрокси(хлор)бутирофенон. Образующийся спирт или галогеналкил в выбранных условиях не алкилирует молекулу фторбензола. Однако при двукратном мольном количестве фторбензола и хлорида алюминия бутирофенон реагирует по кетонной группе, давая производные 4,4-бис-(п-фторфенил)бутиленгликоля, из которых получают препараты пенфлюридол и флуспирилен. Для дальнейшего синтеза галоперидола гидроксигруппу замещают на хлор с помощью тионилхлорида.
Полный синтез и биологическое действие этой группы лекарственных средств приведены в разделе 2.3.
Технологические аспекты проведения процессов ацилирования. Реакцию проводят в среде органического растворителя, которым может быть избыток ArH или другие соединения, не вступающие в реакцию. Аппаратура – эмалированный аппарат, снабженный рубашкой для обогрева паром и охлаждения. Температурный режим обычно 80 – 120 оС, контроль процесса – по скорости выделения HCl. Для выделения продукта реакционную массу, как правило, выливают на подкисленную воду. Хлорид алюминия растворяется в воде, органический слой отделяют на делительной воронке. Отделение от растворителя осуществляют фракционной вакуум-перегонкой либо отгонкой с паром, в зависимости от свойств продукта.
