
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
Алкилирование спиртов и фенолов
В отличие от реакций аминов с алкилирующими агентами, взаимодействие их со спиртами и фенолами идет однозначно. В качестве примера может быть приведен синтез препарата димедрол:

Бензгидрол смешивают с измельченным гидроксидом натрия и прибавляют -диметиламиноэтилхлорид, продукт экстрагируют бензолом и очищают разгонкой в вакууме. Для получения субстанции препарата обрабатывают сухим хлористым водородом жидкий -диметиламиноэтиловый эфир бензгидрола в спирте или в хлорбензоле. Процесс выделения димедрола контролируют потенциометрически.
Исходным продуктом является -диметиламиноэтилхлорид, который получают из -диметиламиноэтанола реакцией с хлористым тионилом. Синтезируют -диметиламиноэтанол из этиленхлоргидрина с избытком диметиламина, либо при взаимодействии диметиламина с этиленоксидом.
Морфолин (тетрагидро-1,4-оксазин), широко используемый в синтезе БАС, получают внутримолекулярным алкилированием гидроксигруппы в диэтаноламине. Реакция идет в присутствии серной кислоты при температуре 170 – 180 оС. После подщелачивания реакционную массу перегоняют.

Также широко используется в тонком органическом синтезе анизол. Его получают метилированием фенола диметилсульфатом:

Процесс идет в мягких условиях, однако в реакцию вступает только одна метильная группа диметилсульфата. Полное использование сырья возможно, если реакцию проводить при 110 – 120 оС.
Алкилирование фенолята натрия в тех же условиях хлоруксусной кислотой дает феноксиуксусную кислоту, которая является промежуточным продуктом при получении феноксиметилпенициллина.
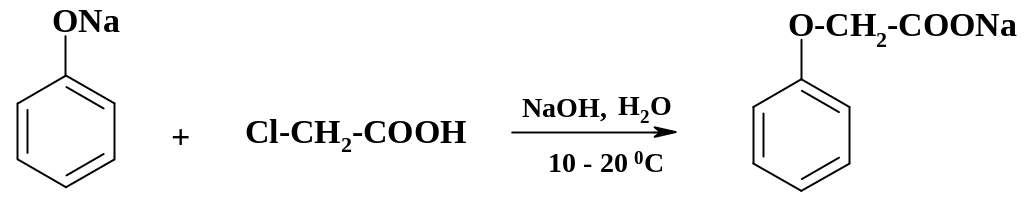
Первой стадией получения препарата папаверин (подробно синтез препарата рассмотрен в разделе 3.7) является метилирование пирокатехина.

Процесс ведут в емкостном аппарате из нержавеющей стали. Растворяют пирокатехин в диметилсульфате, добавляют воду и при интенсивном перемешивании медленно прибавляют из мерника 25 % раствор гидроксида натрия. По сравнению с расчетными данными диметилсульфат берут с двукратным избытком, т. к. в щелочи идет побочная реакция гидролиза метилсерного эфира. После окончания реакции вератрол отгоняют с острым паром. В этом процессе из двух метильных групп диметилсульфата вступает в реакцию только одна. При отгонке вератрола происходит гидролиз метилсульфата натрия с образованием сульфата натрия и метанола.
Аналогично синтезируют о-диэтоксибензол, являющийся исходным продуктом при получении дротаверина (но-шпа). В качестве алкилирующего средства используют диэтилсульфат.
Алкилирование сн кислот
Алкилирование СН-кислот используется при получении барбитуратов. Практическое значение препараты этого ряда получили более ста лет тому назад после открытия Гутдейгом в конце XIX в. снотворного эффекта у барбитала (веронал, 5,5-диэтилбарбитуровая кислота). В настоящее время применяются несколько десятков производных 5,5-диалкил-(или арилалкил)-барбитуратов в качестве снотворных, успокаивающих, противосудорожных средств и препаратов для наркоза. Они усиливают тормозное действие ГАМК, взаимодействуют с определенным участком ГАМК-рецепторного комплекса.
В разделе 2.2.1.1 приведены формулы некоторых лекарственных средств ряда барбитуратов, применяемых в качестве снотворных и успокаивающих препаратов. Многие из них выпускают и применяют в виде натриевых солей, которые хорошо растворимы в воде и дают возможность использовать их в виде инъекционных растворов.
Практически все препараты данного ряда получают по однотипной схеме из диалкил- или алкиларилмалоновых эфиров. Диалкилмалонаты получают ступенчатым введением алкильных радикалов в малоновый эфир реакцией натриймалонового эфира с бромалкилами. Малоновый эфир является слабой СН-кислотой, при взаимодействии с этилатом натрия образуется натриевая соль. Нельзя использовать гидроксид натрия, т. к. в этой реакции выделяется вода и концентрация соли ничтожна. Для алкилирования используют алкилбромиды. Реакционная способность алкильных эфиров серной или бензолсульфокислоты недостаточна. Синтез может быть рассмотрен на примере барбитала и барбамила.

Технологический процесс начинается с приготовления этилата натрия. Эту реакцию проводят в отдельном помещении цеха, т. к. производство является высокопожаро- и взрывоопасным. В реактор из нержавеющей стали загружают натрий и абсолютный спирт, выделяющийся водород через воздушку, выведенную на крышу, сбрасывают в атмосферу через гравийный фильтр. Спиртовый раствор этилата натрия передавливают в следующий реактор, находящийся уже в помещении цеха. К нему приливают небольшими порциями при температуре 10 – 15 оС безводный малоновый эфир, размешивают 0,5 ч и нагревают до 35 5 оС. К полученному раствору натриймалонового эфира при этой же температуре постепенно прибавляют соответствующий бромалкил. После двухчасовой выдержки отгоняют основную массу спирта и в кубовый остаток добавляют воду для растворения бромистого натрия. Смесь отстаивают в делительной воронке: нижний слой водного раствора бромида натрия направляют на регенерацию брома, а верхний слой представляет собой сырой алкилмалоновый эфир, который обычно направляют на вакуум-разгонку. Второе алкилирование ведут аналогично: вначале получают натриевую соль этилмалонового эфира, а затем добавляют алкилбромид. На этой стадии при получении барбитала алкилирование проводят бромистым этилом, а при получении барбамила – бромизопентилом. Алкилирование ведут в более жестких условиях – при температуре 90 – 100 оС. Аналогичным способом вводят второй радикал. Полученный диалкилмалоновый эфир конденсируют с карбамидом в присутствии алкоголята натрия в спиртовом растворе при кипении, при этом получают натриевую соль диалкилбарбитурата. Если препарат используется в виде соли, то технический продукт передают на стадию получения фармакопейного препарата. Когда препарат является производным свободной барбитуровой кислоты, натриевую соль нейтрализуют раствором соляной или уксусной кислоты и после этого также подвергают очистке с целью получения фармакопейного продукта.
Серьезной проблемой промышленного синтеза барбитуратов является дефицит бромистоводородной кислоты, используемой для получения бромалкилов. В настоящее время значительная часть (60 – 70 %) бромистоводородной кислоты регенерируется из растворов бромистого натрия (отход стадии алкилирования малонового эфира), причем применяется одностадийная технология получения бромалкилов, совмещающая реакцию выделения бромистоводородной кислоты из бромистого натрия серной кислотой и реакцию замены гидроксильной группы в спирте на бром:
![]()
В синтезе фенобарбитала исходным сырьем служит цианистый бензил, который является многотоннажным продуктом. Для получения пиримидинового цикла необходимо в качетве промежуточного продукта иметь производное фенилмалоновой или фенилциануксусной кислоты. Поэтому цианистый бензил конденсируют с диэтилкарбонатом в присутствии этилата натрия (условия реакций конденсации и гетероциклизации рассмотрены в разделе 2.7). Образующуюся натриевую соль этилового эфира 2-фенилциануксусной кислоты алкилируют бромистым этилом с получением этилового эфира 2-фе-нил-2-этилциануксусной кислоты. Условия реакции с бромистым этилом те же, что и при получении барбитала.

Для получения конечного продукта проводят циклизацию с циангуанидином, нитрильную и иминогруппу гидролизуют в серной кислоте. Синтез других препаратов этого ряда рассмотрен в разделе 2.7.
