
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:

Одним из способов промышленного получения фенола и анилина является их синтез из хлорбензола. В настоящее время этот метод широко не используется. В приведенных на схеме процессах выделяется хлористый водород, который является высококоррозионно-активным продуктом, тем более при высокой температуре, а в случае получения фенола еще и в присутствии воды. Поэтому длительная эксплуатация аппаратуры в таких условиях обеспечивается применением сплава хастеллой, что удорожает производство. Лучшие результаты получены с использованием керамической аппаратуры. Однако в качестве растворителя хлорбензол широко применяется в органическом синтезе, и его утилизация представляет трудную экологическую проблему. В качестве способа решения данной проблемы получение из отработанного хлорбензола полезных продуктов становится рентабельным.
До внедрения кумольного метода производства фенола этот важный продукт получали щелочным плавлением бензолсульфокислоты. В настоящее время процесс щелочного плавления используют только в производстве малотоннажных веществ. Так в синтезе препарата неостигмин бромида промежуточный м-диметиламинофенол получают из соответствующей сульфокислоты:

К концентрированному водному раствору натриевой соли диметиламинобензолсульфокислоты (получение см. в разделе 2.1.3) постепенно добавляют NaOH и нагревают до 270 оС. Наблюдается бурное выделение воды, для сохранения подвижности расплава воду частично возвращают через обратный холодильник. После окончания реакции снижают температуру, плав «гасят» – разбавляют водой, реакционную массу передают в другой аппарат и подкисляют до рН 4 – 5, выделяющийся диоксид серы поглощают щелочью, осадок целевого продукта отфильтровывают. Однако при наличии в молекуле гидроксигруппы, реакция затруднена. Так при щелочном плавлении при температуре 330 – 350 оС 4-гидроксибензол-1,3-дисульфокислоты замещается только одна сульфогруппа и образуется 3,4-дигидроксибензолсульфокислота.

После гашения плава и десульфирования в 20 % серной кислоте образуется пирокатехин. Это соединение является исходным продуктом при получении препаратов папаверин и дротаверин. Альтернативным промышленным методом получения пирокатехина является щелочной гидролиз о-хлорфенола.
Ранее 8-гидроксихинолин, который используют в синтезе препарата нитроксалин (о биологическом действии см. раздел 2.1.2), получали конденсацией о-аминофенола с глицерином (см. раздел 2.7) в серной кислоте.
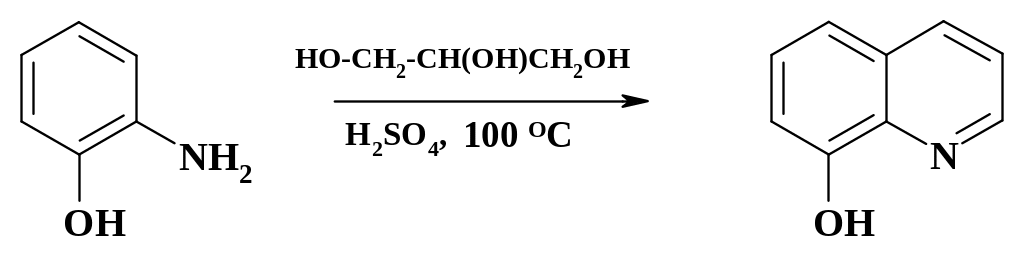
Был разработан способ производства этого продукта, включающий сульфирование дешевого коксохимического хинолина с последующим щелочным плавлением сульфокислоты:

Метод синтеза из о-аминофенола является экологически более чистым. Однако при небольшом тоннаже производства, даже с учетом затрат на природоохранные мероприятия, альтернативная схема более рентабельна.
Наряду с восстановлением нитро- и нитрозогрупп нуклеофильное аминирование в ряду ароматических и гетероциклических соединений является одним из наиболее распространенных способов получения аминопроизводных.
Производство нитроанилинов является крупнотоннажным. Процессы, приведенные на схеме, ведут в автоклавах. Для успешного проведения реакции необходимо использовать пятикратный избыток аммиака. После окончания реакции аммиак стравливают и поглощают водой. Осадок целевого продукта отфильтровывают, к фильтрату добавляют щелочь, аммиак отгоняют и поглощают водой. Раствор аммиака вновь направляют в производство.
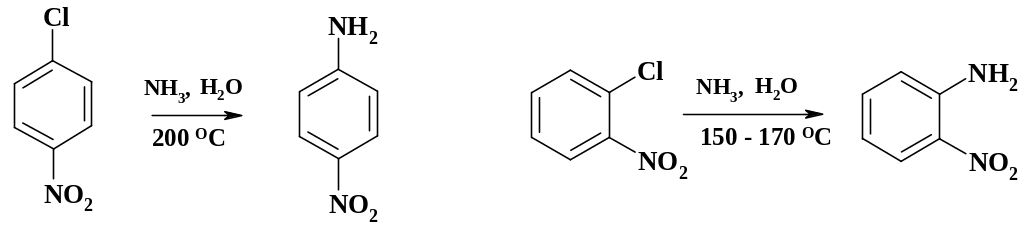
В значительно более мягких условиях проводят замещение хлора на аминогруппу в 2,4-динитрохлорбензоле: реакция идет уже при комнатной температуре. В качестве реагента для проявления хроматограмм при обнаружении аминокислот и пептидов используют 2,4-динитрофторбензол, т. к. реакция замещения фтора идет уже при комнатной температуре.
Как отмечалось в разделе 2.1.1, прямое нитрование фенолов не используется из-за бурного течения реакции, значительного осмоления реакционной массы и больших затрат на разделение изомеров. Промышленным методом получения нитрофенолов является замещение галогена на гидроксигруппу. Так при синтезе парацетамола п-нитрофенол получают щелочным гидролизом п-нитрохлорбензола:

Реакцию ведут в автоклаве при интенсивном перемешивании. Применение межфазного катализа позволяет снизить время проведения процесса с 36 до 12 ч. Замещение хлора в 2,4-динитрохлорбензоле на гидроксигруппу идет уже при 100 оС.
При получении фторхинолоновых препаратов один из атомов фтора замещают на пиперазин либо его метильное производное. Полный синтез препаратов приведен в разделе 2.3. Условия реакции приведены на схеме:

Как отмечалось в разделе 2.1.4, схема синтеза сульфапиридазина и сульфалена отличается от обычного метода получения сульфаниламидных препаратов. В этих случаях используют реакции нуклеофильного замещения в гетероциклическом ядре. В молекуле стрептоцида имеется две аминогруппы: одна в ароматическом цикле, вторая в сульфаниламидной группе. Основность первой группы выше, но в присутствии поташа на атоме азота сульфаниламидной группы возникает целочисленный отрицательный заряд, т. к. эта группировка имеет кислый характер. При солеобразовании возрастает нуклеофильность амидной группы и реакция идет региоселективно. Замещение второго атома хлора в пиридазиновом цикле не происходит в связи с тем, что в цикл уже введен электронодонорный заместитель. Замену оставшегося атома хлора на метоксигруппу проводят с метилатом натрия в автоклаве при температуре 130 оС.

В аналогичных условиях ведут синтез сульфалена:

В азинах атом азота (азагруппа) по своему электроноакцепторному эффекту приближается к нитрогруппе, поэтому реакции идут в отсутствие катализатора.
В состав гипотензивного средства адельфан в качестве одного из компонентов входит 1,4-дигидразинофталазин – дигидралазин. Его получают с помощью замещения атома хлора на гидразиногруппу. Взаимодействие дихлорфталазина с таким сильным нуклеофилом, каким является гидразин гидрат, идет в мягких условиях с замещением обоих атомов хлора:

В отсутствие сильных электроноакцепторных заместителей приходится использовать реакцию Ульмана. Так в синтезе мефенаминовой кислоты проводят взаимодействие о-хлорбензойной кислоты с 3-ксилидином в присутствии мелкодисперсного порошка меди:

Мефенаминовая кислота обладает противовоспалительным, жаропонижающим и анальгезирующим действием, стимулирует заживление ран, стимулирует образование интерферона. Угнетает синтез медиаторов воспаления – простагландинов, серотонина, подавляет активность протеаз лизосом. Болеутоляющее действие связано с действием на центральные механизмы болевой чувствительности. Применяют при остром ревматизме, головной боли, невралгии, полиартрите, простудных и лихорадочных заболеваниях, зубной боли и при парадонтозе.
В синтезе хлорпромазина (аминазина) проводят реакцию анилина с 2,4-дихлорбензойной кислотой. Синтез 2-хлорфенотиазина представлен на схеме:

В разделе 2.2.1 отмечалось, что 2,4-диметокси-6-аминопиримидин, который является промежуточным продуктом в синтезе сульфадиметоксина, не удается получить прямым метилированием аминоурацила. Синтез этого вещества осуществляют с применением реакций нуклеофильного замещения:

При замещении оксогрупп на хлор при действии оксотрихлорида фосфора в качестве катализатора используют диметиланилин.
В производстве сульфамонометоксина 4-амино-6-метоксипиримидин является полупродуктом. Более подробно технологические особенности реакций можно рассмотреть на его примере.

Малондиамид, предварительно полученный обработкой малонового эфира водным аммиаком, и формамид кипятят в метанольном растворе метилата натрия 2 ч, при этом образуется 4,6-диоксопиримидин, который выделяют после отгонки метанола и подкисления реакционной массы раствором HCl до рН 3. Высушенный диоксопиримидин смешивают с оксотрихлоридом фосфора, добавляют диметиланилин и смесь кипятят 3,5 ч, после охлаждения до 10 оС реакционную массу выливают в холодную воду, отфильтровывают осадок 4,6-дихлорпиримидина и промывают его водой до нейтральной реакции промывных вод. Далее ведут ступенчатую замену атомов хлора. Вначале обработкой водным раствором аммиака автоклаве при 50 оС получают 4-амино-6-хлорпиримидин. Затем кипячением в течение 7 часов в 10 % растворе едкого натра в безводном метаноле второй атом хлора в положении шесть пиримидинового цикла замещается на метоксигруппу и образуется целевой 4-амино-6-метоксипиримидин. Конечный продукт выделяют отгонкой метанола и охлаждением кубового остатка до 0 – 3 оС. Общий выход составляет лишь 36 % в пересчете на малондиамид. Тем не менее рассмотренный путь синтеза является наиболее оптимальным.
