
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.2.3.4. Нуклеофильное замещение водорода
Недостатком рассмотренных реакций ипсо-замещения групп (SNipsoAr, SNAr) является то, что для введения в цикл нужной группировки необходимо провести одну или несколько реакций с электрофильными агентами. Только затем один из заместителей обменять на нуклеофил. Весьма привлекательно, подобно реакциям электрофильного замещения, напрямую ввести нуклеофил с отщеплением атома водорода. Но при взаимодействии с электрофильной частицей водород отщепляется в виде протона. В случае реакции с нуклеофилом водород формально должен уходить в виде гидрид аниона. Следовательно, для прямого нуклеофильного замещения водорода необходимо дополнительно использовать акцептор электронов, тогда будет отщепляться протон и два электрона, а акцептор будет восстанавливаться. По классификации эти реакции следует обозначить как SNHAr или сокращенно SNH, т. к. превращение может происходить только в ароматических соединениях. В настоящее время накоплен большой материал, показывающий, что реакции SNH не являются чем-то экзотическим или неожиданным.
Классическим примером такого превращения является реакция Чичибабина:

Пиридин при взаимодействии с амидом натрия в ксилоле или диметиланилине дает 2-аминопиридин. Реакцию можно проводить в других инертных растворителях. В жидком аммиаке процесс идет в гомогенной фазе при температуре минус 33 оС. Использование амида натрия позволяет удалить водород из -аддукта в виде Н2. При занятых в пиридине -положениях образуется производное 4-аминопиридина. Помимо пиридина в реакцию вступают хинолин и его производные, изохинолин, 1-замещенные бензимидазола и производные бензотиазола.
Азины в жидком аммиаке образуют -аддукты, окисление которых перманганатом калия приводит к образованию аминопроизводных. Например 2-метилтио-5-нитропиримидин при взаимодействии с аммиаком при - 40 оС дает 2-метилтио-5-нитро-6-аминопиримидин.

Несмотря на наличие в молекуле двух легко уходящих нуклеофугных групп – метилтио- и нитрогруппы, образуется при кинетическом контроле Н-аддукт (аддукт Сервиса), окисление которого приводит к аминопроизводному. Аналогично реагируют производные хинолина, триазина, птеридина и тетразина.
Выход аминопроизводных в зависимости от типа активированного гетероцикла колеблется от 30 до 80 %.
Активированные азины, в частности четвертичные соли, при взаимодействии с аммиаком, первичными и вторичными аминами при комнатной температуре образуют аминодигидропроизводные. Например, четвертичные соли феназина в реакции с аминами дают Н-аддукт, который превращается в стабильный дигидрофеназин. Окисление последнего кислородом воздуха приводит к четвертичной соли аминофеназина.

Аналогично идет реакция и с производными фенотиазина и феноксазина:
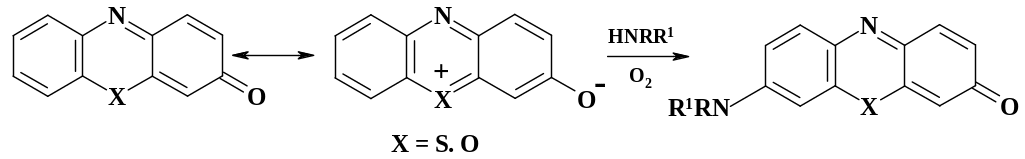
Подобно аминам реагируют и СН-кислоты. Четвертичные соли акридина, как было обнаружено О.Н. Чупахиным, реагируют даже с такими слабыми С-нуклеофилами, как производные анилина:

Промежуточный Н-аддукт был выделен, строение его доказано. Данная работа положила начало циклу систематических исследований реакций нуклеофильного замещения водорода в ряду гетероциклов.
Как отмечалось в разделе 2.1.1, при получении нитробензола из бензола образуется примесь нитрофенолов. Наиболее вероятно, что это является результатом радикальной реакции. Идея прямого получения нитрофенолов из нитробензола с помощью реакции нуклеофильного замещения водорода весьма привлекательна.
По патентным данным при взаимодействие нитробензола с мелкодисперсным КОН в диметоксиэтане в присутствии 18-краун-6-эфира и окислении -аддукта кислородом воздуха с высоким выходом образуются нитрофенолы:

Краун-эфир хорошо комплексует ионы калия. Реакционная способность гидроксид аниона возрастает и реакция идет уже при 60 – 70 оС, выход нитрофенолов составляет 90 – 95 %. Однако нет данных о том, что этот оригинальный метод используется в промышленности. Синтез краун-эфиров и их свойства рассмотрены в разделе 2.7.
Для п-замещенных производных нитробензола при взаимодействии их с порошком КОН и пропускании воздуха показана возможность получения соответствующих нитрофенолов:

Когда X = F, NO2, идет ипсо-замещение этих групп с образованием 4-нитрофенола. Это хорошо иллюстрирует тот факт, что увеличение скорости образование -аддукта Джексона-Мейзенгеймера (см. раздел 2.2.3.3) приводит к протеканию реакции SNipsoAr, а не SNH.
Проведение реакции в жидком аммиаке с использованием в качестве окислителя гидроперекиси кумола дает производные 4-нитрофенола, независимо от характера заместителя Х. Выход нитрофенолов составляет 70 – 90 %.

По всей вероятности, в предыдущем примере реакции SNH лимитирующей стадией процесса является окисление Н-аддукта. Введение в реакционную массу окислителя приводит к преимущественному превращению по механизму SNH. Метод также пока не нашел применения в промышленности.
Аналогично замещению водорода на аминогруппу в гетероциклах, хиноны стабилизируют Н-аддукт после атаки аниона. Так в реакции Тиле-Винтера в кислой среде образуется триацетилгидроксибензол:

Первой стадией процесса является протонирование бензохинона, положительный заряд делокализован между атомом кислорода и углерода цикла. Ацетат анион атакует реакционный центр с образованием -аддукта. Перенос протона из аддукта на атом кислорода хинона приводит к ароматизации цикла. При избытке уксусного ангидрида происходит ацилирование фенольных групп. Триацетильное производное с помощью кислого гидролиза превращают в 1,2,4-тригидроксибензол.
В промышленном синтезе стойкого кубового красителя ализарина (1,2-дигидроксиантрахинона) также наблюдается прямое гидроксилирование. При щелочном плавлении антрахинон-2-сульфокислоты при 280 оС вначале получается 2-гидроксиантрахинон. Наличие хиноидной структуры облегчает атаку гидроксид аниона. Образуется тетранатриевая соль тетрагидроксиантрацена, окисление которой с последующим подкислением дает ализарин.

Получение некоторых красителей антрахинонового ряда включает реакцию замещения водорода гидроксид анионом.
Разработана новая безотходная технология получения п-нитроанилина:

При взаимодействии бензамида, нитробензола, аммиака и кислорода в одну стадию получают п-нитроанилин.
Викариозное нуклеофильное замещение. Во многих случаях прямое введение нуклеофила идет по так называемому типу реакций викариозного замещения водорода (викарий – помощник пастора). Нуклеофил содержит группировку, которая отщепляется и уносит с собой протон из Н-аддукта

При замещении водорода в производных 2,4-динитробензола с двумя молекулами гидроксиламина в этилате натрия образуется аддукт, при разложении которого отщепляются две молекулы воды. При этом получают производные 3,5-диамино-2,4-динитробензола. Ароматизация Н-аддукта происходит за счет переноса протона к атому азота при одновременном отщеплении гидроксид аниона (ОН – викариозная группа).
Хорошим аминирующим агентом является N-аминотриазол:
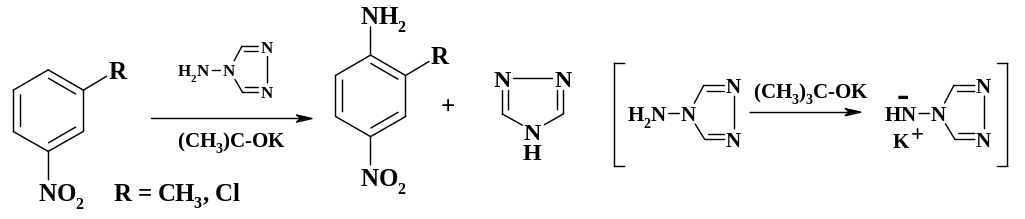
При взаимодействии 3-замещенных производных нитробензола с этим соединением в ДМСО в присутствии третбутилата калия при 20 – 30 оС получены производные нитроанилина. Анионный -аддукт ароматизируется за счет отщепления триазолат аниона и передачи протона к атому азота. Выход целевых продуктов составляет 70 – 90 %.
