
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.1.2.1. Механизм нитрозирования, реагенты
Нитрозирование относится к обычным реакциям электрофильного замещения. Электрофильным реагентом является катион нитрозония. Лимитирующая стадия процесса нитрозирования – отрыв протона от -аддукта. При N-нитрозировании медленной стадией также является отрыв протона от нитрозоаммониевого катиона.

Для проведения реакции используют следующие реагенты:
NaNO2 и HCl или HBr в концентрациях от 10 до 36 %;
NaNO2 и H2SO4 также различной концентрации, в зависимости от свойств субстрата;
Alk-O-NO в кислой среде в органическом растворителе.
В обычных условиях (нитрит натрия в кислоте) образование нитрозоний катиона происходит по следующей схеме:
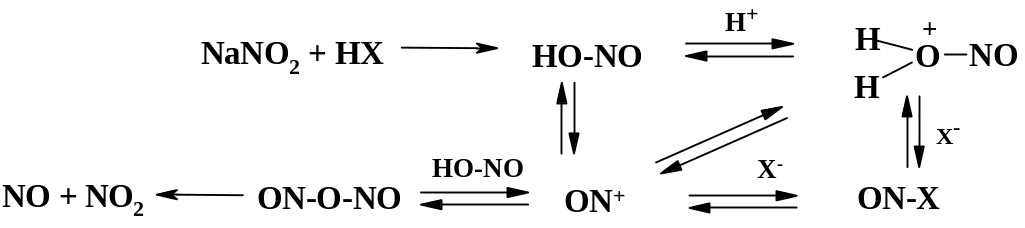
Строгий кинетический анализ из-за сложного равновесия между HONO и NO+ не дает удовлетворительных результатов. Эмпирические закономерности показывают, что если не удается проведение реакции с высоким выходом целевого продукта в разбавленной HCl, то необходимо повысить ее концентрацию. Если это не помогает, то следует добавить KBr, т. к. реакционная способность нитрозилбромида выше, чем нитрозилхлорида. Наиболее активным нитрозирующим агентом является нитрозилсерная кислота, которую готовят отдельно – растворяют NaNO2 в концентрированной серной кислоте при 70 оС. Алкилнитриты в промышленности стараются не использовать в связи с их высокой пожароопасностью и высокой токсичностью. Рекомендуется использовать количество NaNO2, близкое к эквимолекулярному, либо с незначительным избытком. Большой избыток этого реагента приводит к чрезмерному выделению оксидов азота NO и NO2, а также протеканию побочных процессов.

Классическим примером одного из побочных процессов является нитрозирование п-фенолсульфокислоты четырехкратным мольным избытком нитрита натрия. Образующееся нитрозосоединение дает 4-сульфо-о-хинондиазид.
2.1.2.2. Особенности проведения реакции
Нитрозирование является реакцией электрофильного замещения. В отличие от нитрования, нитрозирование имеет существенные ограничения по структуре субстрата. Агентом в реакции является катион нитрозония – NO+, существенно более слабый электрофил, чем катион нитрония. В связи с этим региоселективность процесса выше, чем при нитровании. Однако если в молекуле ароматического или гетероциклического соединения имеются слабые электронодонорные заместители, такие как CH3, Alk, OCH3, OAlk, а тем более электроноакцепторные – NO2, CF3, NO, COOAlk, COAlk, Hal (Cl, Br, I, F), то реакция в обычных условиях не идет. Нитрозобензол получают окислением анилина перманганатом калия в присутствии формалина в серной кислоте. И только при наличии таких сильных электронодонорных групп, как OH, NH2, NHAlk, NHAr, N(Alk)2, в мягких условиях может быть осуществлена реакция нитрозирования. Повторное прямое нитрозирование во всех изученных случаях провести не удается, т. к. нитрозогруппа является электроноакцепторным заместителем. Даже при наличии электронодонорных заместителей имеются ограничения. Так, в том случае, если в молекуле субстрата реакции имеется первичная аминогруппа, за редким исключением идет реакция диазотирования.
![]()
Прямое С-нитрозирование первичных аминов удалось осуществить добавлением амина к охлажденному раствору NaNO2 в концентрированной серной кислоте без доступа влаги. В качестве продуктов реакции всегда образовывались п-нитрозоанилины. Так были получены 4-нитрозопроизводные 1-нафтиламина и его 2-, 6-, 7- и 8-моносульфокислот, а в бензольном ряду – нитрозопроизводные м-анизидина и м-толуидина.
Если в молекуле субстрата имеется вторичная аминогруппа, то в первую очередь образуется N-нитрозосоединение. Это обусловлено тем, что на атоме азота заряд выше, чем на атомах углерода цикла. При действии кислот на образующееся соединение происходит перегруппировка с получением С-нитрозопродукта (реакция Фишера-Хеппа). Реакцию используют для получения п-нитрозоалкиланилинов нитрозированием N-моноалкиланилинов.

Вначале образуются N-нитрозоалкиланилины, а при действии на них кислоты выделяют целевые продукты. Следует отметить, что лучшие результаты получены при использовании соляной кислоты. На первой стадии перегруппировки происходит денитрозирование, а затем образующийся из NO+ и Cl- нитрозилхлорид атакует атом углерода в п-положение цикла.
Способность нитрозоний катиона атаковать атомы азота используют при синтезе нитрозоалкилмочевины и ее производных, которые далее могут расщепляться по следующей схеме:

Реакция нитрозирования идет также и с СН-кислотами:

При растворении СН-кислоты в щелочи на атоме углерода, связанном с электроноакцепторными группами, возникает отрицательный заряд. При добавлении в реакционную массу кислоты вновь образуется СН-кислота. Однако имеется ионизированная форма с очень малой концентрацией, а ее реакционная способность достаточно велика. Это позволяет успешно провести нитрозирование.
Нитрозирование спиртов дает алкилнитриты, использующиеся в качестве нитрозирующих средств. Одним из первых препаратов, который начали применять для расширения коронарных сосудов, был изоамилнитрит (амилнитрит).

В настоящее время из-за выраженного побочного действия как антиангинальное средство он не используется. Однако этот препарат является антидотом при отравлениях синильной кислотой.
