
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):

При кислотном гидролизе протон -аддукта смещается к атому кислорода карбонильной группы, образуется хинолинкарбоновая кислота и альдегид. Это превращение позволяет получать широкий круг альдегидов.
N-Оксиды азинов легко вступают в реакции нуклеофильного замещения водорода. Так при взаимодействии хинолин-N-оксида с тозилхлоридом и спиртами в присутствии триэтиламина образуются 2-алкоксихинолины:

Аналогично N-оксиды реагируют с N-, P- и С-нуклеофилами.
Реакция с С-нуклеофилом используется в синтезе промежуточного продукта при получении диазепама. Препарат диазепам (седуксен, реланиум, сибазон, валиум) является транквилизатором. Полный синтез препарата приведен в разделе 2.7.

При взаимодействии п-нитрохлорбензола с цианистым бензилом в щелочной среде в условиях реакции нитрил фенилуксусной кислоты, как СН-кислота, образует анион, который атакует молекулу нитрохлорбензола с получением -аддукта. Его стабилизация происходит за счет отщепления цианистого натрия, дегидратация приводит к производному бензоизоксазола. Выход бензоизоксазола составляет 70 %.
Кине-, телезамещение водорода. Как уже отмечалось, при взаимодействии нуклеофила с ареном быстро образуются -аддукты Сервиса. Это объясняет аномальное течение реакций нуклеофильного замещения, когда нуклеофил встает в о- или м-положение к нуклеофугной группе (кине- и теле-замещение).
Так при взаимодействии 2,3-динитронафталина с гидразин гидратом, в отличие от о-динитробензола, образуется 1-гидразино-3-нитронафталин:

При взаимодействии о-нитробензонитрила с цианид ионом также наблюдается нуклеофилное замещение:

В Н-аддукте происходит атака кислорода нитрогруппы с образованием оксазиридиноксида. Его расщепление дает 2,6-дицианофенол и оксид азота.
В качестве примера теле-замещения можно привести реакцию амида калия в жидком аммиаке с 8-хлор-1,7-нафтиридином:
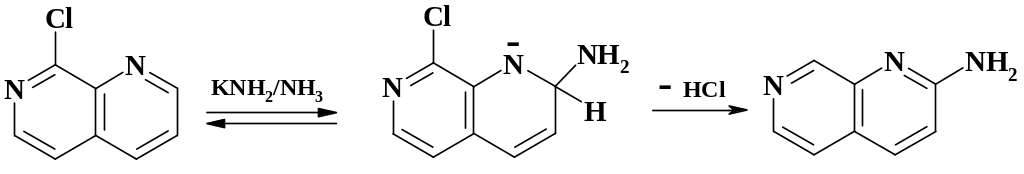
В отличие от классической реакции Чичибабина, в данном случае отщепляется хлороводород, а не водород.
2.2.3.5. Замещение гидроксигрупп
Фенолы, не содержащие электроноакцепторных группировок, вступают в реакцию аминирования при высоких температурах. Так фенол реагирует с аммиаком в паровой фазе при давлении 20 МПа и температуре 400 оС на стационарном алюмосиликатном катализаторе, давая анилин с выходом 98 %.
C6H5-OH → C6H5-NH2
Метод может конкурировать с традиционным способом получения анилина из нитробензола. Следует отметить, что в этом варианте практически нет отходов.
Стабилизатор каучуков 2-фениламинонафталин получают из анилина и нафтола-2 при 240 – 250 оС в расплаве с добавкой хлорида анилиния или бензолсульфокислоты:

Процесс ведут в течение 6 ч при отгонке воды. Полученный продукт перегоняют в вакууме. При более низкой температуре идет замещение в полигидроксипроизводных. Пропускание аммиака в расплав резорцина при 160 оС приводит к м-аминофенолу. Реакцией с диметил- и диэтиламинами получают соответствующие производные м-аминофенола:

Важное промышленное значение имеет замещение гидроксигруппы на аминогруппу в присутствии солей сернистой кислоты (реакция Бухерера). Эта группа реакций не относится к нуклеофильному замещению в ароматическом ряду, т. к. механизм процесса другой. Он представлен на схеме:

Гидросульфит натрия присоединяется по двойной связи молекулы 1-окси-нафталина с получением 1-оксотетралин-3-сульфокислоты. Амины реагируют с кетогруппой по механизму присоединения-отщепления (см. раздел 2.2.2). После отщепления воды уходит также и сульфогруппа. При получении неозона Д по этому способу реакция идет в воде уже при 110 – 120 оС вместо 240 – 250 оС в отсутствии гидросульфита натрия. Данным методом синтезируют азосоставляющие: Гамма-кислоту, кислоту Тобиаса и Н-кислоту (аминонафталинсульфокислоты). Способ используется при получении препарата митоксантрон, который является синтетическим аналогом антрациклиновых антибиотиков. Митоксантрон используют для лечения рака молочной железы с локальными и отдаленными метастазами, острого лейкоза и миелолейкоза. Препарат нарушает структуру и функции ДНК, блокирует топоизомеразу II в раковых клетках.

Восстановленный тетрагидроксиантрахинон (лейкотетрагидроксиантрахинон) может находиться в двух таутомерных формах. С амином в бутаноле при 100 оС реагирует форма диона, образующееся аминопроизводное окисляют кислородом воздуха до целевого продукта.
Следует отметить то, что препарат окрашивает животные ткани и может вызвать мутации. Поэтому при его синтезе необходима тщательная защита персонала от контакта с веществом.
