
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.1.5.9. Техника безопасности, экология
Ароматические соединения являются токсичными веществами и ЛВЖ. При работе с ними принимают обычные меры предосторожности. Раздражающим дыхательные пути действием обладают уксусный ангидрид и хлорангидриды кислот, поэтому необходимо избегать их разлива или рассыпания, а при попадании на кожу обработать пораженное место раствором соды. Безводный хлористый алюминий дымит на воздухе, интенсивно поглощает воду, его загружают из барабана в один прием. Обезвреживание стоков:
AlCl3 + 3 NaOH Al(OH)3 + NaCl
Гидроксид алюминия может быть использован в качестве сорбента.
2.1.6. Галогенирование
Использование реакции галогенирования при синтезе лекарственных средств. Реагенты, катализаторы, механизм реакции галогенирования в ароматическое ядро, кинетика реакций, закономерности. Практика проведения хлорирования, бромирования и иодирования. Энергия и механизм реакции свободнорадикального галогенирования. Хлорирование в боковую цепь ароматических соединений. Хлорирование и бромирование спиртов, альдегидов, кетонов и кислот.
Атомы галогенов – F, Cl, Br и I – являются фармакофорными группами. Кроме того, галогенирование относится к одной из важных реакций в синтезе промежуточных продуктов для введения в молекулу таких группировок, как NR1R2, OH, OCH3, OC2H5, SH, SR, CN и др. с помощью реакций нуклеофильного замещения.
2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
В качестве примера наличия фармакофорных свойств галогеногрупп можно продемонстрировать ряд препаратов с разнообразной активностью:
![]()
Хорошо известное средство для наркоза – хлороформ, трихлорацетальдегид гидрат является снотворным препаратом.
Нейролептики. Одним из основных нейролептиков является хлорпромазин (аминазин) – 2-хлор-10-(3-диметиламинопропил)фенотиазин. Оказывает успокаивающее действие на ЦНС, понижает температуру тела, усиливает действие снотворных, наркотических, болеутоляющих и противосудорожных средств. Применяют в психиатрии для лечения психомоторных возбуждений, в хирургии – для усиления действия наркотизирующих и болеутоляющих средств, для гипотермии при операциях на сердце, для лечения шока. Кроме того, аминазин снимает неукротимую рвоту при лечении противоопухолевыми препаратами и лучевой терапии. Действие препарата обусловлено блокадой центральных дофаминоэргических и адренаргических рецепторов. В отсутствие атома хлора в цикле активность существенно меньше. Трифлюороперазин (трифтазин) – один из наиболее активных антипсихотических лекарственных препаратов. Вместо атома хлора в аминазине в данном препарате находится трифторметильная группа.

Транквилизаторы бензодиазепинового ряда. Латинское traquillo – делать спокойным, безмятежным. Биологическое действие транквилизаторов – успокаивать ЦНС, не оказывая антипсихотической активности. Препараты тормозят образование дофамина и норадреналина. В качестве примеров приведены формулы диазепама (сибазон, седуксен, реланиум) и феназепама:

Бензодиазепины применяют при различных невротических, психопатических, психопатоподобных состояниях; снимают страх, тревогу, раздражительность и эмоциональную лабильность; обладают легким седативным (снотворным) действием. Бензодиазепины, не содержащие в молекуле атомы галогенов, обладают слабой активностью.
Препараты различных классов, содержащие атомы галогенов, представлены на следующей схеме:

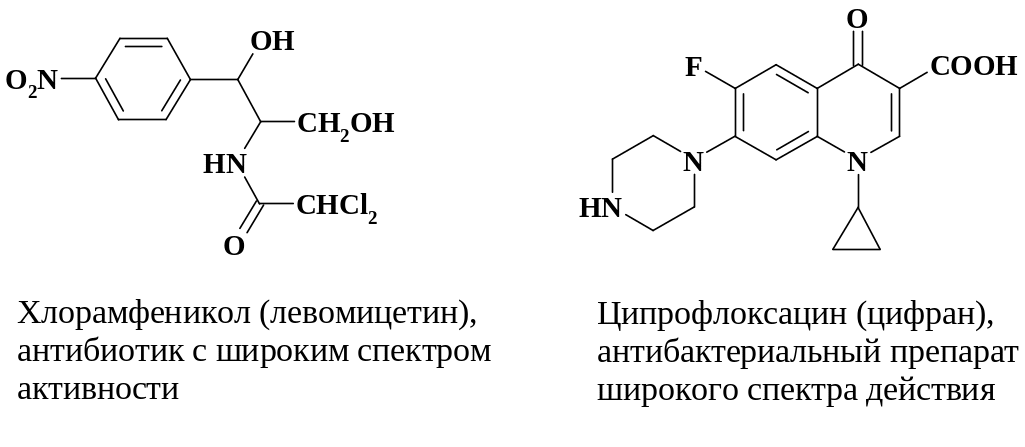
Приведенные примеры показывают, что галогенирование является одним из важных для медицинской промышленности процессов. Однако реакции галогенирования имеют особенности, которые необходимо подробно рассмотреть при разработке метода синтеза целевого продукта.
