
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
2.1.5.7. Реакция карбоксилирования
Прямое введение карбоксигруппы в ароматическое ядро (реакция Кольбе – Шмидта) имеет большие ограничения по структуре реагирующего субстрата, однако используется в медицинской промышленности. В отличие от других реакций электрофильного замещения, СО2 – очень слабый электрофил, не способный реагировать с ароматическими углеводородами. И только в случае фенолятов, обладающих очень высокой реакционной способностью, удается в приемлемых технологических условиях получить карбоксипроизводные. Важнейшим производством с использованием реакции карбоксилирования является синтез салициловой кислоты:

При взаимодействии сухого феноксида натрия при температуре 170 – 180 оС и давлении СО2 0,4 – 0,6 МПа образуется натриевая соль салициловой кислоты. Ориентацию в о-положение можно объяснить тем, что происходит стабилизация -аддукта.
При использовании солей К+, Rb+ или Cs+, имеющих больший ионный радиус, чем натрий, образование такого комплекса из-за пространственных помех невозможно и образуется п-гидроксибензойная кислота. Это же соединение получают и при проведении реакции при температуре 250 оС. Данный изомер термодинамически более выгоден (термодинамический контроль реакции).
При наличии в молекуле двух гидроксигрупп (резорцин) или амино- и гидроксигруппы реакция идет уже в воде при температуре 100 оС:

Этим способом получают п-аминосалициловую кислоту (ПАСК), которая является противотуберкулезным препаратом.
Технология. Растворяют в автоклаве фенол в конц. NaOH, упаривают раствор и дополнительно высушивают фенолят натрия. Затем начинают подавать под давлением СО2 и повышают температуру до 180 оС. Нагревание автоклава осуществляют подачей высокотемпературного пара в «мятую» рубашку или с помощью электрообогрева. Перемешивание сухого феноксида натрия осуществляют с помощью мощной ножевой (гребковой) мешалки. Реакцию ведут до полного расхода фенолята натрия. Реакционную массу охлаждают и растворяют в воде. Водный раствор передают в аппарат и подкисляют водным раствором HCl. Продукт отфильтровывают и для очистки проводят его сублимацию.
Синтез производных бензойной кислоты возможен также с помощью реакции арена с оксалилхлоридом:
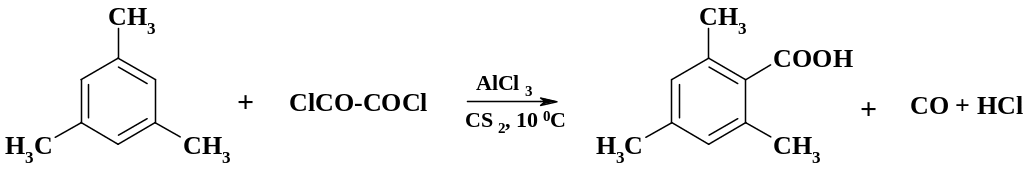
Препаративное значение для получения карбоновых кислот имеет реакция литий- или магнийорганических соединений с углекислым газом.
Декарбоксилирование является обратной реакцией карбоксилирования и широко используется в органическом синтезе.
2.1.5.8. Карбоксилирование алифатических соединений
Промышленное значение, в т. ч. и для получения ЛС, имеет группа реакций карбоксилирования алифатических соединений.

Следует отметить реакцию Коха-Хаафа – получение третичных карбоновых кислот карбоксилированием олефинов. В основе процесса лежит разложение муравьиной кислоты на оксид углерода и воду:
HCOOH + H2SO4 = CO + H2O
Оксид углерода присоединяется к карбокатиону и реагирует с водой. Кроме алкенов аналогично реагируют галогеналкилы и спирты:

Эта реакция используется в синтезе противогриппозного препарата римантадин (см. раздел 2.1.6), где бромадамантан превращают в адамантанкарбоновую кислоту. Взаимодействие оксида углерода с алкинами, алкенами, спиртами, алкилгалогенидами и простыми эфирами в присутствии солей никеля при высоком давлении (реакция Реппе) приводит к получению карбоновых кислот:
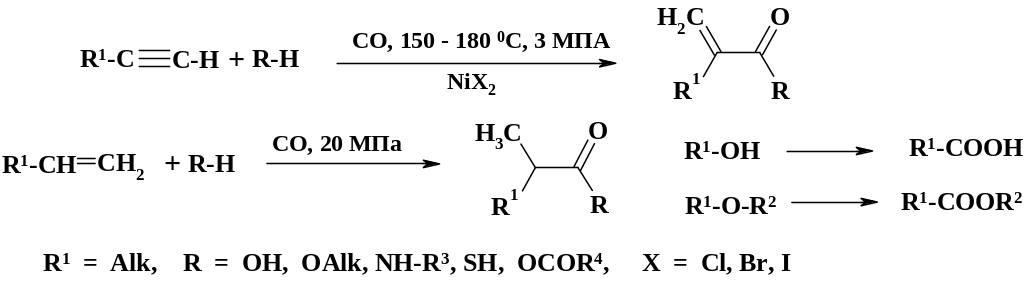
Реакция имеет промышленное значение для синтеза низших карбоновых кислот из спиртов.
