
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
6.4. Классификация и общая характеристика пав
По химическим свойствам в соответствии
с характером диссоциации полярных групп
ПАВ делятся на анионные, катионные,
амфолитные и неионогенные. В мировом
производстве ПАВ 60% составляют анионные,
30%-неионные, 10%-катионные, и лишь доли %
- амфолитные. Анионные ПАВ - это органические
соединения, молекулы которых, диссоциируя
в воде, образуют анион с крупным
углеводородным радикалом, обладающий
поверхностной активностью. Катион не
является поверхностно-активным на
границе вода-воздух. Анионные ПАВ
содержат гидрофильные функциональные
группы:
![]() ,
,
![]() ,
,
![]() и т.д.
и т.д.
К анионным ПАВ относятся соли карбоновых
кислот (мыла)
![]() ;
соли ароматических сульфокислот
(алкилбензолсульфонаты)
;
соли ароматических сульфокислот
(алкилбензолсульфонаты)
![]() ;
соли эфиров серной кислоты (алкилсульфаты)
;
соли эфиров серной кислоты (алкилсульфаты)
![]() ;
алкилсульфонаты
;
алкилсульфонаты
![]() ;
олефинсульфонаты.
;
олефинсульфонаты.
Катионные ПАВ диссоциируют в воде с
образованием органического катиона,
обладающего поверхностной активностью.
К ним относятся алифатические и
ароматические амины, их соли четырех
замещенные аммониевые основания,
производные пиридина. Катионные ПАВ
содержат гидрофильные функциональные
группы
![]() ,
,
![]() .
С помощью катионных ПАВ стабилизируют
дисперсные системы с получением
положительно заряженных частиц. Катионные
ПАВ являются токсичными и наименее
биоразлагаемыми из всех ПАВ. Они вводятся
в состав различных лекарственных и
моющих средств, т. к. обладают бактерицидной
активностью. Токсичность катионных ПАВ
может быть снижена путем ассоциации с
синтетическими полиэлектролитами.
.
С помощью катионных ПАВ стабилизируют
дисперсные системы с получением
положительно заряженных частиц. Катионные
ПАВ являются токсичными и наименее
биоразлагаемыми из всех ПАВ. Они вводятся
в состав различных лекарственных и
моющих средств, т. к. обладают бактерицидной
активностью. Токсичность катионных ПАВ
может быть снижена путем ассоциации с
синтетическими полиэлектролитами.
Амфолитные ПАВ содержат в молекуле кислотную (карбоксильную) и основную (амино) группы. В зависимости от среды они проявляют свойства как катионных, так и анионных ПАВ и могут вести себя как неионогенные. К ним относятся аминокислоты и белки.
Неионогенные ПАВ содержат гидрофильные
функциональные группы
![]() ,
,
![]() .
Общая формула неиогенных ПАВ имеет
следующий вид:
.
Общая формула неиогенных ПАВ имеет
следующий вид:
![]() ,
где
,
где
![]() .
Неионогенные ПАВ являются растворимыми
как в кислой так и в щелочной среде
соединениями, не диссоциирующими в
воде. К ним относятся продукты присоединения
окиси этилена к веществам с развитыми
углеводородными радикалами:
оксиэтилированные спирты
.
Неионогенные ПАВ являются растворимыми
как в кислой так и в щелочной среде
соединениями, не диссоциирующими в
воде. К ним относятся продукты присоединения
окиси этилена к веществам с развитыми
углеводородными радикалами:
оксиэтилированные спирты
![]()
![]() ,
,
![]() ,
,
![]() ;
оксиэтилированные алкилфенолы
;
оксиэтилированные алкилфенолы
![]() ,
,
![]() ,
;
полиэтиленгликолевые эфиры жирных
кислот
,
;
полиэтиленгликолевые эфиры жирных
кислот
![]() .
Оксиэтилированные спирты легко
разлагаются в биосреде, а оксиэтилированные
алкилфенолы – нет.
.
Оксиэтилированные спирты легко
разлагаются в биосреде, а оксиэтилированные
алкилфенолы – нет.
Фторированные ПАВ могут относиться к любому классу – быть ионными, неионными, или амфотерными. Их особенность состоит в том, что при гидрофобной части молекулы, состоящей из 8 атомов углерода, они проявляют свойства, характерные для углеводородных соединений с той же полярной группой, содержащих 16 ÷ 18 атомов углерода. Фторированные ПАВ характеризуются высокой поверхностной активностью при низких концентрациях.
6.5. Свойства водных растворов пав. Мицеллообразование
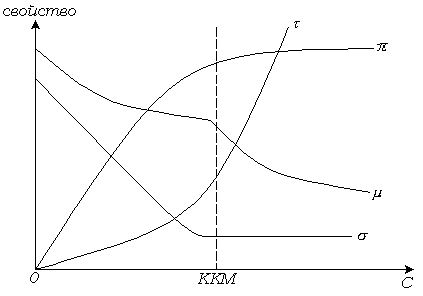
Рис. 6.2. Изменение свойств растворов ПАВ в зависимости от концентрации.
Водные растворы ПАВ проявляют необычные физико-химические свойства. В разбавленных растворах ионные ПАВ ведут себя как нормальные электролиты. При достижении определенной концентрации резко изменяются такие физико-химические свойства, как осмотическое давление, электропроводность, мутность и поверхностное натяжение (рис. 6.2).
Скорость, с которой осмотическое давление увеличивается с концентрацией, становится аномально низкой, что указывает на ассоциацию молекул. Высокое значение электропроводности при этой концентрации свидетельствует о сохранении значительной диссоциации на ионы. Резко возрастает мутность растворов, а на изотерме поверхностного натяжения появляется перелом. Резко изменяется также моющая способность растворов ПАВ.
Мак Бен объяснил наличие двух ветвей на концентрационных зависимостях свойств образованием агрегатов или мицелл ионов ПАВ, в которых липофильные углеводородные цепи ориентированы внутрь мицеллы, а гидрофильные группы находятся в контакте с водной фазой (рис. 6.3).
Рис. 6.3. Строение сферической мицеллы ПАВ в воде.
Абсцисса точки излома соответствует критической концентрации мицеллообразования (ККМ), т. е. концентрации, выше которой становится возможным образование мицелл. Одна ветвь на кривых изменения свойств растворов ПАВ характеризует молекулярное состояние ПАВ в растворе, другая соответствует коллоидному состоянию ПАВ.
Образование мицелл, подобно адсорбции, приводит к уменьшению межфазной энергии раствора ПАВ. Тепловое движение и электростатическое отталкивание между заряженными полярными группами на поверхности мицеллы препятствует образованию мицелл.
Мицеллы образуют только ПАВ, обладающие
оптимальным соотношением между
гидрофобной и гидрофильной частями, т.
е. величиной гидрофильно-липофильного
баланса (ГЛБ). К мицеллообразующим ПАВ
относятся натриевые, калиевые, и
аммониевые соли жирных кислот с длиной
цепи
![]() ,
алкилсульфаты, алкилбензосульфонаты
и другие ионогенные и неионогенные ПАВ.
Истинная растворимость таких ПАВ
невелика и достигает тыс. долей моль/л
для ионогенных и два порядка ниже для
неионогенных ПАВ. При малой общей
концентрации ПАВ в системе
,
алкилсульфаты, алкилбензосульфонаты
и другие ионогенные и неионогенные ПАВ.
Истинная растворимость таких ПАВ
невелика и достигает тыс. долей моль/л
для ионогенных и два порядка ниже для
неионогенных ПАВ. При малой общей
концентрации ПАВ в системе
![]() все вещество находятся в виде истинного
раствора, и мицелл практически нет (рис.
6.4).
все вещество находятся в виде истинного
раствора, и мицелл практически нет (рис.
6.4).

Рис. 6.4. Зависимость растворимости ионогенных ПАВ от температуры.
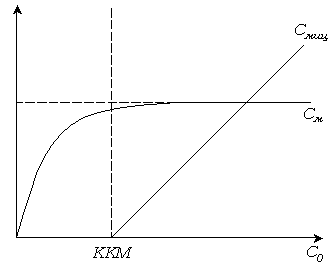
Рис. 6.5. Зависимость количества вещества в молекулярно-растворенной форме от общей концентрации.
![]() может на несколько порядков превышать
может на несколько порядков превышать
![]() .
Поэтому мицеллы являются депо, для
поддержания постоянной концентрации
ПАВ при его расходовании.
.
Поэтому мицеллы являются депо, для
поддержания постоянной концентрации
ПАВ при его расходовании.
При достижении ККМ в узкой области концентраций вблизи ККМ начинается образование мицелл. Практически все вновь вводимое вещество переходит в мицеллярное состояние, повышая концентрацию вещества, находящегося в растворе.
![]()
Концентрация молекулярно-растворенного вещества остается почти постоянной (рис. 6.5).
