- •Биология дрожжей
- •Глава 1. Зарождение и развитие знаний о дрожжах
- •Глава 2. Дрожжевая клетка. Цитология
- •Компоненты дрожжевой клетки Ядро
- •Митохондрии
- •Цитоплазматическая мембрана
- •Эндоплазматический ретикулум и комплекс Гольджи
- •Вакуоли
- •Клеточная стенка
- •Капсула
- •Цитоплазма
- •Изменения клеточных структур в онтогенезе
- •Цитологические особенности дрожжей в различных условиях роста
- •Глава 3. Морфология и бесполое размножение
- •Макроморфология дрожжей
- •Микроморфология дрожжей
- •Типы вегетативного размножения
- •Псевдомицелий
- •Истинный мицелий
- •Диморфизм и плеоморфизм
- •Баллистоспоры
- •Эндоспоры
- •Хламидоспоры
- •Клеточный цикл
- •Глава 4. Половое размножение и жизненные циклы дрожжей
- •Дифференциация пола у дрожжей
- •Аскомицетовые дрожжи
- •Гаплоидные дрожжи
- •Диплоидные дрожжи
- •Гапло-диплоидные дрожжи
- •Базидиомицетовые дрожжи
- •Глава 5. Особенности метаболизма
- •Спиртовое брожение
- •Субстраты брожения
- •Дыхание
- •Углеводы
- •Жирные кислоты и н-алканы
- •Одноуглеродные соединения
- •Ароматические соединения
- •Вторичные продукты метаболизма
- •Источники азота
- •Глава 6. Лимитирующие факторы
- •Температура
- •Активность воды
- •Кислотность среды
- •Ингибиторы роста
- •Киллерный эффект у дрожжей
- •Глава 7. Распространение дрожжевых грибов в природе
- •Специфические локусы развития дрожжей Виноград и другие сочные плоды
- •Нектароносные цветки и насекомые-опылители
- •Сокотечения деревьев
- •Разлагающиеся ткани кактусов
- •Буровая мука насекомых-ксилофагов
- •Кишечный тракт беспозвоночных животных
- •Дрожжи на растениях, растительных остатках и в почве
- •Эпифитные дрожжи
- •Растительные остатки
- •Смена дрожжевых сообществ при разложении растительных остатков
- •Географические закономерности в распространении дрожжей
- •Лесная полоса
- •Пустыня
- •Высокогорья
- •Функции дрожжевых грибов в природных экосистемах
- •Жизненные формы дрожжей
- •Глава 8. Дрожжи - возбудители заболеваний человека
- •Кандидоз
- •Криптококкоз
- •Malassezia
- •Глава 9. Промышленное использование дрожжей
- •Традиционные процессы
- •Виноделие
- •Пивоварение
- •Хлебопечение
- •Дрожжи в современной биотехнологии Дрожжи как источник белка
- •Производство этанола
- •Различные продукты, получаемые из дрожжей
- •Глава 10. Систематика дрожжей
- •Концепция вида у дрожжей
- •Признаки и критерии, используемые в систематике дрожжей
- •Стандартное описание вида у дрожжей
- •Моносахаридный состав клеточных стенок
- •Тип кофермента q
- •Ультраструктура септовых пор
- •Особенности систематики анаморфных дрожжей
- •Коллекции дрожжей
- •Идентификация дрожжей
- •Роды дрожжей
- •Аскомицетовые дрожжи
- •Роды аскомицетовых дрожжей
- •Базидиомицетовые дрожжи
- •Роды базидиомицетовых дрожжей
- •Литература
- •Ресурсы Интернета Сайты крупнейших коллекций дрожжей:
- •Сайты некоторых научных журналов, наиболее часто публикующих статьи по биологии дрожжей:
- •Персональные страницы крупнейших зимологов
- •Дрожжевая клетка
- •Цитоплазматическая мембрана
- •Фосфолипиды
- •Стероиды
- •Ядрышко
- •Нуклеолемма
- •Бляшка (центриолярная пластинка)
- •Конденсация днк и образование хромосом
- •Хромосомы
- •Митохондрии
- •Petite-мутации и генетика митохондрий
- •Микротрубочки
- •Полисомы
- •Вакуоли в дрожжевых клетках
- •Эндоплазматический ретикулум
- •Комплекс Гольджи
- •Пероксисомы
- •Гликоген
- •Строение клеточной стенки
- •Моносахариды клеточной стенки дрожжей
- •Полисахаридный состав клеточной стенки
- •Β-Глюкан
- •Маннопротеины клеточной стенки
- •Капсулы дрожжей при различных способах микроскопирования
- •Внеклеточные полисахариды липомицетов
- •Пуллулан
- •Меланоидные пигменты
- •Астаксантин
- •Трегалоза
- •Рост дрожжей на н-алканах
- •Гигантские колонии
- •Рост различных видов дрожжей на скошенном агаре
- •Красные дрожжи
- •«Черные дрожжи»
- •Рост в жидких средах
- •Типы вегетативного размножения у дрожжей
- •Клеточный цикл
- •Артрический и бластический конидиогенез
- •Форма клеток и типы почкования у различных дрожжей
- •Голобластическое и энтеробластическое почкование
- •Шрамы почкования
- •Многостороннее почкование
- •Мицелиально-дрожжевой диморфизм
- •Истинный мицелий
- •Псевдомицелий
- •Бластоспоры
- •Артроспоры
- •Баллистоспоры
- •Хламидоспоры
- •Эндоспоры
- •Апрессории
- •Жизненный цикл
- •Мейоз и споруляция
- •Аски и аскоспоры
- •Дифференциация пола у дрожжей
- •Механизм конверсии mat-гена
- •Типы полового процесса у дрожжей
- •Педогамия
- •Гологамия
- •Адельфогамия
- •Слияние гаметангиев
- •Образование аска
- •Зиготические и азиготические аски
- •Аски на мицелии у дрожжеподобных грибов
- •Форма аскоспор у дрожжей
- •Число спор в аске
- •Лизирующиеся аски
- •Поверхность аскоспор в сканирующем электронном микроскопе
- •Жизненный цикл Schizosaccharomyces pombe
- •Жизненный цикл Debaryomyces hansenii
- •Жизненный цикл Nadsonia elongata
- •Жизненный цикл Lipomyces tetrasporus
- •Жизненный цикл Saccharomycodes ludwigii
- •Жизненный цикл Hanseniaspora uvarum
- •Жизненный цикл Saccharomyces cerevisiae
- •Жизненный цикл Metschnikowia pulcherrima
- •Базидии и базидиоспоры
- •Дикариотический мицелий с пряжками
- •Телиоспоры
- •Типы базидий
- •Морфология промицелия со споридиями у различных видов диморфных базидиомицетов
- •Жизненный цикл Rhodosporidium toruloides
- •Жизненный цикл Filobasidiella neoformans
- •Жизненный цикл Tremella mesenterica
- •Общая схема метаболизма дрожжей
- •Гликолиз
- •Глицериновое брожение у дрожжей
- •Вторичные продукты брожения
- •Эффект Пастера и эффект Кребтри
- •Цикл Кребса
- •Пентозофосфатный цикл
- •Цикл β-окисления
- •Цепь переноса электронов
- •Синтез атф
- •Β-Кетоадипиновый путь
- •Метилотрофные дрожжи
- •Ксилулозо-монофосфатный цикл
- •Механизм расщепления мочевины
- •Антимикотики
- •Киллерный эффект
- •Потребность дрожжей в витаминах
- •Учет дрожжей методом посева
- •Применение низкотемпературной инкубации для селективного выделения дрожжей
- •Учет липомицетов методом обрастания почвенных комочков
- •Метод отпечатков для исследования эпифитных дрожжей
- •Метод fish
- •Микробиологические методы определения витаминов
- •Температурные диапазоны роста дрожжей
- •Психрофильные дрожжи
- •Ксеротолерантные дрожжи
- •Комменсализм
- •Форезия
- •Жизненные формы дрожжей
- •Дрожжи на ягодах винограда и других сахаристых плодов
- •Дрожжи в цветочном нектаре
- •Дрожжи в сокотечениях деревьев
- •Сукцессии дрожжей в сокотечениях деревьев
- •Дрожжи в разлагающихся тканях кактусов
- •Медвяная роса
- •Эпифитные дрожжи
- •Автохтонные почвенные дрожжи
- •Бактериально-дрожжевые ассоциации
- •Дрожжи в домашней пыли
- •Кандидоз
- •Созревание вина
- •«Дикие дрожжи»
- •«Чайный гриб»
Применение низкотемпературной инкубации для селективного выделения дрожжей
|
|
|
|
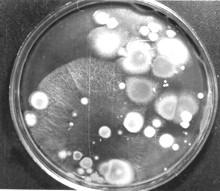
Посев из образца лесной подстилки, инкубация 3 сут. при комнатной температуре |
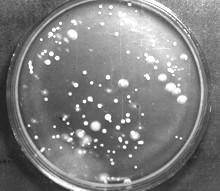
Посев из этого же образца, инкубация 14 сут. при 5°C |
Учету и выделению дрожжей из природных субстратов методом посевасильно мешают мицелиальные грибы, присутствующие в изучаемом субстрате. Колонии грибов маскируют более мелкие дрожжевые колонии и затрудняют их изоляцию. Ограничить рост мицелиальных грибов химически невозможно: всеингибиторы ростамицелиальных грибов действуют и на дрожжи. Однако, при температуре около 5°С дрожжевые колонии в среднем развиваются быстрее. Кроме того, в почве, на растениях и растительных остатках значительную долю могут составлятьпсихрофильные дрожжи, не растущие при температуре выше 22-25°C. Поэтому при учете дрожжей в природных местообитаниях часто применяют метод низкотемпературной инкубации посевов.
Учет липомицетов методом обрастания почвенных комочков
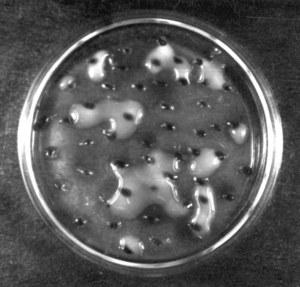
Клетки липомицетовв почве прочно адсорбированы на поверхности почвенных агрегатов. Этому способствуют мощныекапсулы, состоящие изполисахаридовс карбоксильными группами, взаимодействующие с катионами. Поэтому клетки липомицетов с трудом переходят в водную суспензию, и даже после многократных отмываний почвенной навески они в основном остаются в осадке и, следовательно, не обнаруживаются при стандартном посеве из разведений.
Для обнаружения и учета численности липомицетов применяют метод почвенных комочков на среде Эшби (состав в г/л: сахароза - 20, K2HPO4- 0.2, KH2PO4- 0.1, MgSO4- 0.2, NaCl - 0.2, K2SO4- 0.1, агар - 20, вода - 1 л.). После стерилизации среду подкисляют молочной кислотой до pH 4.0 для подавления роста бактерий, или добавляют антибактериальные антибиотики.
Навеску около 0.1 г почвы раскладывают в виде 50-100 мелких комочков на поверхности среды в чашке Петри. Инкубирование проводят при комнатной температуре в течение 2-3 нед. Для предотвращения высыхания среды чашки лучше инкубировать во влажной камере.
Липомицеты образуют характерные слизистые обрастания вокруг комочков. Метод является полуколичественным: численность липомицетов выражают относительным числом комочков со слизистыми обрастаниями (в процентах от общего количества комочков).
Из обрастаний почвенных комочков липомицеты можно выделить в чистую культуру. Для этого материал из обрастаний переносят петлей в чашку с подкисленной средой и рассевают истощающим штрихом. Отдельные колонии липомицетов пересевают в пробирки.
Метод отпечатков для исследования эпифитных дрожжей
|
|
|
|
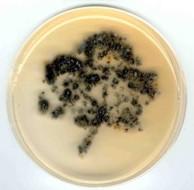
Отпечатки листьев на поверхности сусло-агара, образованные выросшими колониями эпифитных дрожжей. Преобладающие черные колонии - Aureobasidium pullulans. | |
Простой способ изучения эпифитныхдрожжей - посев методом отпечатков листьев. Для этого лист прижимается на некоторое время к поверхности агаровой среды. Прилипшие к среде клетки дрожжей прорастают и после инкубации на чашке появляется изображение листа из выросших колоний. На фотографии видно, что наибольшее количество колоний расположено вдоль проводящих жилок листа, так как именно в районе жилок в основном происходитэкссудацияпитательных веществ.
Как правило, методом посева из суспензии измельченных листьев удается выявить большее разнообразие дрожжей, чем методом отпечатков, что говорит о том, что клетки эпифитных дрожжей могут быть плотно адсорбированына поверхности листьев, или даже расти внутри растительной ткани (эндофитные дрожжи). С другой стороны, при измельчении листьев могут высвобождаться фитонциды, ингибирующие рост дрожжей.