
- •Механизм:
- •Нитриты
- •Гидразиды
- •3) Из сл.Эфиров
- •Дикарбоновые кислоты
- •Ненасыщенные дикарбоновые кислоты
- •Ароматические дикарбоновые кислоты
- •Сульфоновые кислоты
- •Ароматические (фенолокислоты)
- •Производные солициловой кислоты
- •1) Произ-ые по –cooh:
- •2) Ппроизв-ые по –oh:
- •Оксокислоты
- •Алкилирование
- •Природные α-аминокислоты
- •Специфич.Св-ва аминокислот.
- •Пептиды и белки
- •С троение пептидной группы
- •Химический метод синтеза пептидов(классич)
- •Твердофазный синтез пептидов (тфсп)
- •Важнейшие пентозы:
- •Важнейшие гeксозы:
- •Стереоизомерия
- •Таутомерия
- •Конформации моносахаридов.
- •Конформация галактоперонозы
- •Химические св-ва моносахаридов.
- •Качественные реакции обнаружения гексоз., и пентоз.,
- •Другие представители моносахаридов.
- •Аминосахара
- •Дисахариды
- •Химические св-ва:
- •Полисахариды
- •Крахмал
- •Аминопектин
- •Декстраны
- •Пособы получения:
- •Галогенирование
- •Специфич.Реакции
- •Пятичленные гетероциклы с 2-мя гетероатомами
- •Имидазол. Получение:
- •Важнейшие производные:
- •Производные пиразола.
- •3(5)-Оксипиразол пиразолон-3(5)
- •Синтез антипирина
- •Синтез амидо из антипирина
- •Хинолин
- •Производные хинолина
- •Производные пиримидина
- •Синтез барбитуровой к-ты.
- •Оксазины
- •Тиазины
- •Производные фенотиазина
- •Мочевая к-та.
- •Метилированные ксантины
- •Птеридин
- •Аллоксазин изоаллоксазин.
- •Алкалоиды
- •**Морфин
- •** Кокаин
- •Нуклеиновые ( азотистые основания)
- •Нуклеозиды:
- •Нуклеотиды
- •2 Цепи в этой спирали антипараллельны, т.Е.Их 5’ и 3’-межнуклеотидные фосфодиэфир.Мостики параллельны противоположно.
- •Коферментные нуклеотиды
- •2)Флавиновые ( фмн и фад)
- •Терпены
- •Циклические
- •Производные камфана :
- •Стероидные гормоны (половые г.И г.Коры надпочечников)
- •Желчные кислоты
- •Стерины
- •Омыляемые липиды
- •Простые липиды
- •Обзорная лекция
- •Задачи:
Сульфоновые кислоты
-SO3H сульфо группа
*алифатические R-SO3H
*ароматические Al-SO3H
Получение: а) алифатические
- сульфоокисление алканов
- жесткое окисление тиолов
б) ароматические
- сульфирование аренов
R -J+(NH2)2SO3
R-SO3NH4+
NH4J
-J+(NH2)2SO3
R-SO3NH4+
NH4J
K2SO3 / Na2SO3
Химические свойства: кислотные свойства сравнимы с силой серной кислоты. Анион стабилен, за счет делокализации заряда между 3-мя ат.кислорода.
 O -1/3
O -1/3
R – S O
-1/3
– S O
-1/3
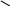 O -1/3
O -1/3
Функциональные производные
 O
O
R -S-Cl
-S-Cl
O
Хлорангидриды(сульфанилхлориды)
1. Сульфохлорирование алкана
hO
R H+SO2+Cl2 R-SO2Cl
-HCl
2 . RSO3H+PCl5 RSO2Cl+POCl3+HCl
Эфиры
O O
R -S-OH+R’OH R-S-OR’ + H2O
O O
Сульфоамиды
O O R’
R
 -S-NH2
R-S-I
O O R”
-S-NH2
R-S-I
O O R”
Незамещенные Замещенные
Дисульфирование
R
t SO3H+H2O
R–H+H2SO4
(использ.для защиты опред.полож.бензольного
кольца)
SO3H+H2O
R–H+H2SO4
(использ.для защиты опред.полож.бензольного
кольца)
перегретый пар
A
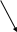 rSO3H
+NaOH
ArSO3Na
NaOH ArONa
HOH ArOH
(фенол)
rSO3H
+NaOH
ArSO3Na
NaOH ArONa
HOH ArOH
(фенол)
-H2O CH,to
Na NaNH2 NaHS,to
ArCN ArNH2 Ar-SH тиофенол
Гетерофункц.органич.соед.
Это органич.соединения, содержащие различные функц.группы.
Биогенные представители:
Аминоспирты и аминофенолы.
** Коламин ( 2-аминоэтанол)
СH2-CH2 (компонент сложных липидов)
N
 H2
OH
H2
OH
** Холин ( триметил – 2 – гидроксил этиламмоний) – регулирует жировой обмен.
HO-CH2-CH2N-(CH3)3
** Ацетилхолин (нейромедиатор)
O
H 3C-C-O-CH2N+(CH3)3
3C-C-O-CH2N+(CH3)3
* *Дофамин
*Дофамин


H O-
CH2
CH2NH2
O-
CH2
CH2NH2
 HO- предшественники
адреналина
HO- предшественники
адреналина
* * НА
Н
 О-
CH
CH2NH2
О-
CH
CH2NH2
 OH-
OH
OH-
OH
** Адреналин
H
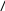 O-
CHCH2NH2CH3
O-
CHCH2NH2CH3
 OH-
OH-
Парааминофенол
НО получение: восстановление паранитрофенола
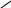 Ядовит,
быстро окисляется, но его производные
этими свойствами не обладают и
Ядовит,
быстро окисляется, но его производные
этими свойствами не обладают и
 применяются
в медицине в качестве жаропонижающих
средств.
применяются
в медицине в качестве жаропонижающих
средств.
NH2
 OH
OC2H5
OH
OC2H5

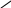
 C2H5OHOH
C2H5OHOH
 -H2O
фенетидин
-H2O
фенетидин
N H2 NH2
(
 CH3CO)2
+(CH3CO)2O
CH3CO)2
+(CH3CO)2O
О
 Н
OC2H5
Н
OC2H5

 +C2H5OH
+C2H5OH



NHCOCH3  Парацетамол NHCOCH3
Парацетамол NHCOCH3
Гетерофункцион.карб.к-ты Это производные карб.кислот, содержащие в углеводор.радикале, др.атомы вместо ат.водорода.
Классификация: *по природе радикала
-алифатич.
-ароматич.
-алициклич.
*по взаимному расположению –Hal и – COOH
у: -алифатич.:γ, β, α и т.д. γ β α
R-CH2-CH2-CH-COOH
CH3
- ароматич.:
орто COOH
ароматич.:
орто COOH
 мета Cl
мета Cl
пара
 O-
O-
Получение: 1. α-галогенирование карб.к-т по Гельду-Фольгарду-Зелинскому
2. β-присоединение Hal – H к α, β – ненасыщ.карб.к-т.
Химические свойства: 1. По COOH
- кислотые св-ва выше, чем у монокарб.к-т, т.к. Hal за счет –J, являем ЭА, стабилизирует анион по мере удаления Hal, влияние ослабевает α>β>γ
С числа ат. Hal, к-ть
- образование функциональных производных по реак.Sn
Hal ангидриды, сл.эфиры, амиды и т.д.
2. с участием Hal по Sn2 механизму


 +NH3
R-CH-COOH
+NH3
R-CH-COOH
-NH4Cl NH2
R
 -CH-COOH
-CH-COOH
Cl OH O

 +2NaOH
R-CH-C
+2NaOH
R-CH-C
ONa
У аромат. Sn замещение идет в жестких условиях. Замещение Hal расположенного в орто и пара положениях идет легче, чем у мета.
Гидроксикислоты
Различие в зависимости от природы С-Н радикала
алиф(спирты)
аромат(фенолокислоты)
А лифатические
О
лифатические
О
О
 сновные:
** гликолевая (2-гидроксиэтановая)
СН2-С
сновные:
** гликолевая (2-гидроксиэтановая)
СН2-С
ОН ОН
** молочная (2-гидроксипропановая)
α-оксипропионовая, соли-лактаты)
С Н3-СН-COOH
OH
Двухосновные:
** Яблочная (гидроксибутандиовая)
H OOC-CH-CH2-COOH
OOC-CH-CH2-COOH
CH
** Винная(2,3- дигидроксибутандиовая)
H OOC-CH-CH-COOH
OOC-CH-CH-COOH
OH OH
Трехосновные: ** Лимонная ( 2-гидрокси -1,2,3-пропантрикарб.к-та)
 OH
OH
H OOC-CH2-C-CH2COOH соли-цитраты.
COOH
Способы получения: *Гидролиз Hal карб.к-т(α,β,γ)
*Гидролиз гидроксинитрилов
 O
α
O
α
R


 -C
HCN
R-CH-CaN
H2O
R-CH-COOH
-C
HCN
R-CH-CaN
H2O
R-CH-COOH
H OH OH
*Гидратация α,β – непредельных карб.к-т
*Восстановление соответствующих оксо-соединений.
Химические свойства: 1. По – COOH гр.
2. По – OH гр.
Кисл.св-ва: Sn реакции (HCl, PCl3,SOCl2, простые, сложные эфиры, окисление)
3. Специфические св-ва:
Отношение к нагреванию позволит определить взаимное расположение этих функц.групп.
** α-гидроксикислоты при нагревании подвергаются межмолекулярной дегидратации с образованием сл.циклических эфиров лактидов.
 O
O
O
O
R – CH - C R-CH-C
– CH - C R-CH-C
H




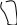
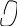 O
OH to
O
O
O
OH to
O
O
O H
HO -2H2O
C – CH-R
H
HO -2H2O
C – CH-R


 C-CH O
C-CH O
O R
** β-гидроксикислоты при нагревании отщепляют воду внутримолекулярно с образованием α,β-ненасыщ к-т
R
 -CH2
-CH-CH-COOH to
R-CH2-CH=CH-COOH
-CH2
-CH-CH-COOH to
R-CH2-CH=CH-COOH

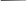 OH H
-H2O
OH H
-H2O
** γ-гидроксикислоты при to-также внутримолекулярно с образованием сл.цикл.эфира-лактона.
H2C-CH2 H2C-CH2
R
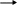

 -CH
C=O to
R-CH C=O лактон
-CH
C=O to
R-CH C=O лактон
HO OH -H2O O
** расщепление α-гидроксикислот.
При to в присутствии H2NO3(к) идет расщепление по С1, С2, связи с образованием карбонильного соед. и муравьиной к-ты, α-ая разлагается дальше.

 O-H
O
O-H
O



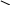 R-C-COOH
to,
H2SO4(k)
HCOOH + R-C
R-C-COOH
to,
H2SO4(k)
HCOOH + R-C
H CO H2O H
C OOH
OOH
CH2 COOH to, H2SO4(k) HCOOH + COOH to CH3
C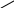
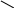



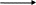 CO H2O
CH2
-2CO2 C=O
CO H2O
CH2
-2CO2 C=O
CH2 OH C=O CH3
C OOH CH2
COOH
Ацетондикарбоновая к-та.
