
- •Механизм:
- •Нитриты
- •Гидразиды
- •3) Из сл.Эфиров
- •Дикарбоновые кислоты
- •Ненасыщенные дикарбоновые кислоты
- •Ароматические дикарбоновые кислоты
- •Сульфоновые кислоты
- •Ароматические (фенолокислоты)
- •Производные солициловой кислоты
- •1) Произ-ые по –cooh:
- •2) Ппроизв-ые по –oh:
- •Оксокислоты
- •Алкилирование
- •Природные α-аминокислоты
- •Специфич.Св-ва аминокислот.
- •Пептиды и белки
- •С троение пептидной группы
- •Химический метод синтеза пептидов(классич)
- •Твердофазный синтез пептидов (тфсп)
- •Важнейшие пентозы:
- •Важнейшие гeксозы:
- •Стереоизомерия
- •Таутомерия
- •Конформации моносахаридов.
- •Конформация галактоперонозы
- •Химические св-ва моносахаридов.
- •Качественные реакции обнаружения гексоз., и пентоз.,
- •Другие представители моносахаридов.
- •Аминосахара
- •Дисахариды
- •Химические св-ва:
- •Полисахариды
- •Крахмал
- •Аминопектин
- •Декстраны
- •Пособы получения:
- •Галогенирование
- •Специфич.Реакции
- •Пятичленные гетероциклы с 2-мя гетероатомами
- •Имидазол. Получение:
- •Важнейшие производные:
- •Производные пиразола.
- •3(5)-Оксипиразол пиразолон-3(5)
- •Синтез антипирина
- •Синтез амидо из антипирина
- •Хинолин
- •Производные хинолина
- •Производные пиримидина
- •Синтез барбитуровой к-ты.
- •Оксазины
- •Тиазины
- •Производные фенотиазина
- •Мочевая к-та.
- •Метилированные ксантины
- •Птеридин
- •Аллоксазин изоаллоксазин.
- •Алкалоиды
- •**Морфин
- •** Кокаин
- •Нуклеиновые ( азотистые основания)
- •Нуклеозиды:
- •Нуклеотиды
- •2 Цепи в этой спирали антипараллельны, т.Е.Их 5’ и 3’-межнуклеотидные фосфодиэфир.Мостики параллельны противоположно.
- •Коферментные нуклеотиды
- •2)Флавиновые ( фмн и фад)
- •Терпены
- •Циклические
- •Производные камфана :
- •Стероидные гормоны (половые г.И г.Коры надпочечников)
- •Желчные кислоты
- •Стерины
- •Омыляемые липиды
- •Простые липиды
- •Обзорная лекция
- •Задачи:
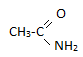
Амиды
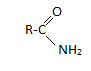
а![]() мидоуксусная
кислота
мидоуксусная
кислота
ацедамид
этанамид
![]()
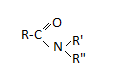
Замещенные амиды
м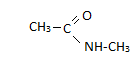 етиламид
уксусной кислоты
етиламид
уксусной кислоты
N-метилацетамид
N-метилэтанамид
Способы получения: 1. Из галогенангидридов
2. Из ангидридов
3. Из сл.эфиров
4. Нагревание солей карбоновых кислот
5. Гидролиз нитрилов
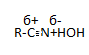
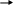
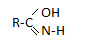
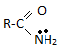
Химические свойства: **Кислотно-основные
Основн. св-ва понижены из-за сопряжения
H+
.

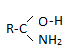
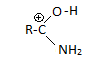
Кисл. св-ва слабые (сравнивая с кисл. св-ми спиртов)
+ NaNH2
NaNH2
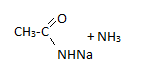
Амид
Натрия
С кислотностью и основностью связано образование межмолекулярных ассоциатов из-за водородных связей
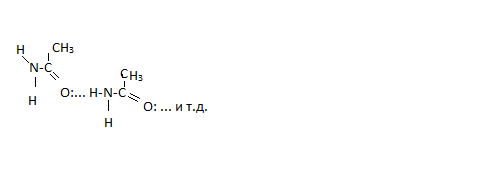
** Реакции ацилирования
NH2 – силльный ЭД, q на карбонильном ат.углерода
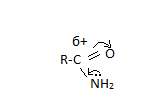 -
NH2:
- J; + M
-
NH2:
- J; + M
+ M> - J; (ЭД)
NH2– - нестабильная плохоуходящая группа
Гидролиз в кислой и щелочной средах, являющихся необратимыми.
В кислой среде
+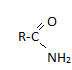
 НОН HCL
НОН HCL
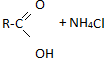
В щелочной среде
O O

 R-C + NaOH
R-C + NH3
R-C + NaOH
R-C + NH3

NH2 ONa
** Реакция дегидрадации
R![]() -CaN
-CaN
Нитрил.
** Расщепление азотистой кислотой


 O
O
O
O
+
 НО-NOR-C
R-C
НО-NOR-C
R-C
 NH-NO
-N2
OH
NH-NO
-N2
OH
N-нитрозоамид
** Расщепление по Гофману
 O
O
R -CH2-C
+NaOBr
R-CH2-NH2-CO2-NaBr
NH2
-CH2-C
+NaOBr
R-CH2-NH2-CO2-NaBr
NH2
** Реакция восстановления

 O [H]
O [H]
R -C
R-CH2-NH2
-C
R-CH2-NH2
NH2 LiAlH4
n- замещенные дают первич., вторич., третич. амины
** Ацимерование
 О O
O
O
О O
O
O
С

 Н3-С
+ CH3
–C
-HCl
CH3-C-NH-C-CH3
Н3-С
+ CH3
–C
-HCl
CH3-C-NH-C-CH3
NH3 Cl имид
* *
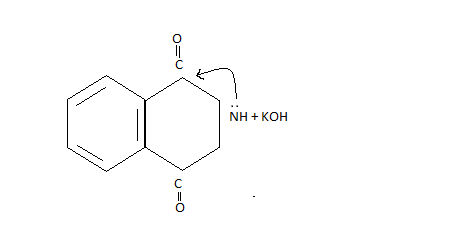
Алкилирование O
*
Алкилирование O

 O
N-алкил
R-C
NHR’
O
N-алкил
R-C
NHR’
R




 -C
+ R’Cl
OR’
-C
+ R’Cl
OR’
 NH2
О- алкил R-C
NH2
О- алкил R-C
NH
Иминовый эфир
Циклические имиды



Фтолимид
Сложные эфиры
O O этиловый эфир уксусной кислоты
R
 -C
CH3-C
этилацетат
-C
CH3-C
этилацетат
OR’ OC2H5 этилэтаноат
Способы получения: 1) Реакция этирификации
2) Через ангидриды
3) Алкилирование солей карб.кислот галогеналканами
Химические свойства: ** Гидролиз
а) в кисл.среде (обратимый)
O H+ O
R
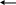 -C
+ HOH R-C + R’OH
-C
+ HOH R-C + R’OH

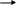
 OR’
OH
OR’
OH
Механизм:
O: O+-H OH +НОН H
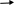

 R-C
+ H+ R-C
R-C+ R-C-OR’
R-C
+ H+ R-C
R-C+ R-C-OR’




 OR’
КАТ.
OR’ OR’
O+
OR’
КАТ.
OR’ OR’
O+
Карбокатион I H H
Оксониевый ион I
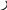 H R’OH O-H
O
H R’OH O-H
O

 R-C-OR R-C+ R-C +
H+
R-C-OR R-C+ R-C +
H+
 OH
H
O-H
O-H
возврат кат.
OH
H
O-H
O-H
возврат кат.
оксониевый ион II карбокатион II
б) в щелочной среде (необратимый)
O O
R
 -C
+ NaOH R-C
+ R’OH
-C
+ NaOH R-C
+ R’OH
OR’ ONa
Механизм:
 Oб
O-
O O
Oб
O-
O O
R

 б+-C
+ OH-
F
R-C-OR’ R-C
+ R’O-
R-C
+ R’OH
б+-C
+ OH-
F
R-C-OR’ R-C
+ R’O-
R-C
+ R’OH
OR’ OH OH O- стабильный анион
Неустойчивый, они образуют
т.к. нет условий для более устойчивую
его стабилизации пару
Щелочной гидролиз называют омылением, т.к. при гидролизе жиров, яв-ся сл.эфирами трехатомного спирта и высших карб.кислот, образующих мыла.
** Взаимодействие с аммиаком, первич. и вторич. аминами ( амманолиз и аминолиз )
O O
R -C + NH3R-C + R‘OH
OR’ NH2
амид
O O
R -C + R”NH2 R-C + R’OH
OR’ NHR”
O H+ O
** R-C + R”OH F R-C + R’OH
OR’ OR”
** Сложно-эфирная конденсация Кляйзена ( идет при наличии Н у α- углеродного атома)
O O
2
 СH3-C
C2H5ONa
CH3-C-CH2-C
СH3-C
C2H5ONa
CH3-C-CH2-C

 OC2H5
O
OC2H5
OC2H5
O
OC2H5
Этиловый эфир ацетоуксусной кислоты
Если взять 2 разных эфира, то образ. смесь 4-х разных продуктов.
** Восстановление
Чаще до первич. спиртов, реже в альдегиды и простые эфиры.
O
R -C
+
[H]
R-CH2-OH-R’OH
-C
+
[H]
R-CH2-OH-R’OH
OR’
Нитриты
R-CaN CH3–CaN нитрил уксусной к-ты
Ацетонитрил
Этанонитрил
CH2=CH–CaN акрилонитрил (пропенонитрил)
Способы получения: 1) Дегидратация амида
2) Взаим.галогеналканов с цианидами щелочн.Ме
R–Cl+KCNR–CN+KCl
3) Из солей диазония
Химические свойства: ** Гидролиз ( в кислой и щелочной средах)
Труднее, чем у других ацильных производных.
O
R-CaN+HOHR-C HOH to
N
 H2
H2
** Восстановление
R-CaN+[H]R–CH2–NH2
O O
R
 -C
R-C R’
-C
R-C R’
NH-NH2 NH-N
 R’
R’
Гидразиды
Способ получения:1) Из галогенангидридов
(как амиды) 2) Из ангидридов
3) Из сл.Эфиров
Х имические свойства: O свободная
 R-C
R-C
NH-NH2
 Основные и нуклеофильные св-ва
Основные и нуклеофильные св-ва
O
+ HCl CH3-C
 O
NH-NH3+Cl-
N-ацетилгидрозинский
хлорид
O
NH-NH3+Cl-
N-ацетилгидрозинский
хлорид
С H3-C
O
O
O
H3-C
O
O
O
 NH-NH2
+ CH3-C
СН3-С-NH-NH-C-CH3
N,N-диацетилгидридразид
NH-NH2
+ CH3-C
СН3-С-NH-NH-C-CH3
N,N-диацетилгидридразид
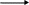 -HCl
Cl
-HCl
Cl

 O
O
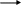 + CH3-C
СН3-C-NH-N=CH-CH3
этиледенгидридразид уксусной к-ты
+ CH3-C
СН3-C-NH-N=CH-CH3
этиледенгидридразид уксусной к-ты
H
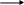 + HNO2
CH3-C-N—N+aN
азид уксусной к-ты
+ HNO2
CH3-C-N—N+aN
азид уксусной к-ты
Гидраксамовые кислоты
O Получают как амиды. Реагент NH2OH ( гидроксиламин). Проявляют слабые
R -C кислотные свойства. Образуют окрашенные комплексы: FeFe2+, Cu2+, Mn2+,
NH которые используются для обнаруж.функции производных карбоновых кислот.
R

 -C=O
O-N-H
-C=O
O-N-H

 Cu
Cu
H-N-O O=C-R
