
- •Механизм:
- •Нитриты
- •Гидразиды
- •3) Из сл.Эфиров
- •Дикарбоновые кислоты
- •Ненасыщенные дикарбоновые кислоты
- •Ароматические дикарбоновые кислоты
- •Сульфоновые кислоты
- •Ароматические (фенолокислоты)
- •Производные солициловой кислоты
- •1) Произ-ые по –cooh:
- •2) Ппроизв-ые по –oh:
- •Оксокислоты
- •Алкилирование
- •Природные α-аминокислоты
- •Специфич.Св-ва аминокислот.
- •Пептиды и белки
- •С троение пептидной группы
- •Химический метод синтеза пептидов(классич)
- •Твердофазный синтез пептидов (тфсп)
- •Важнейшие пентозы:
- •Важнейшие гeксозы:
- •Стереоизомерия
- •Таутомерия
- •Конформации моносахаридов.
- •Конформация галактоперонозы
- •Химические св-ва моносахаридов.
- •Качественные реакции обнаружения гексоз., и пентоз.,
- •Другие представители моносахаридов.
- •Аминосахара
- •Дисахариды
- •Химические св-ва:
- •Полисахариды
- •Крахмал
- •Аминопектин
- •Декстраны
- •Пособы получения:
- •Галогенирование
- •Специфич.Реакции
- •Пятичленные гетероциклы с 2-мя гетероатомами
- •Имидазол. Получение:
- •Важнейшие производные:
- •Производные пиразола.
- •3(5)-Оксипиразол пиразолон-3(5)
- •Синтез антипирина
- •Синтез амидо из антипирина
- •Хинолин
- •Производные хинолина
- •Производные пиримидина
- •Синтез барбитуровой к-ты.
- •Оксазины
- •Тиазины
- •Производные фенотиазина
- •Мочевая к-та.
- •Метилированные ксантины
- •Птеридин
- •Аллоксазин изоаллоксазин.
- •Алкалоиды
- •**Морфин
- •** Кокаин
- •Нуклеиновые ( азотистые основания)
- •Нуклеозиды:
- •Нуклеотиды
- •2 Цепи в этой спирали антипараллельны, т.Е.Их 5’ и 3’-межнуклеотидные фосфодиэфир.Мостики параллельны противоположно.
- •Коферментные нуклеотиды
- •2)Флавиновые ( фмн и фад)
- •Терпены
- •Циклические
- •Производные камфана :
- •Стероидные гормоны (половые г.И г.Коры надпочечников)
- •Желчные кислоты
- •Стерины
- •Омыляемые липиды
- •Простые липиды
- •Обзорная лекция
- •Задачи:
Желчные кислоты
В основе лежит УВ- холановая к-та.
22


 21 23
21 23
CH3 20 24
CH3
Синтезируются в печени, выд.в составе желчи.
Из желчи ч/кА выдел.4к-ты. Наиб.знач. холевая к-та.
** холевая к-та.
OH
CH3 COOH 3α,7α,12α-тринидрокси-5β-холоновая к-та.
CH3 Н с д
в Н H
HO H OH
Особенности строения:
1) кольца А и В им.цис-сочлен.
2)все гидрокильные гр.заним.оксиальное полож.
**дезоксихолевая к-та.
OH
CH3 COOH
CH3 Н
Н H
HO H
Синтез ж.к.поступ.в кишечник, но прежде конденс.с 2-мя типами соед:
а) с глицином








 Д С=O
Д C=O
Д С=O
Д C=O
OH + HNHCH2COOH NHCH2COOH
-H2O гликохолевая к-та.
б) с таурином
С=O C=O
OH + HNHCH2СН2SO3H NHCH2CH2SO3H
-H2O таурохолевая к-та.
получ.к-ты-парные желч.к-ты, помогают в переварив.жиров.
Na+, K+ соли гликохолевой к-ты облад.поверхностно-активн.св-ми и эмульгируют жиры.
Кроме того они актив.кофермент липазу, активиз.гидролиз жиров.


 O
O
O
O


 C-N-CH2-C
Na+
C-N-CH2-C
Na+
H O- гидрофильная часть
CH3
HO OH гидрофобная часть
Стерины
В основе лежит УВ-холистан.
22 24 26


 21
21
CH3 20 23 25
CH3 27
Стер до ины- гидроксипроизвод.халистана.
Разные стерины отлич.степенью ненасыщ.углер.скелета, а также длиной цепи у С17 ( от 8 до 10)
Ралич.животные стерины ( зоостерины), раст( фико), грибов ( мико).
** холестерин.
Холестерин -5-ол -3, β.
Встр.в орг.как в свобод.виде, так и в виде слож.эфиров холистеридов.
20% пост.с пищей, ост.часть синтезир.из CH3COOH.
CH3
CH3
 HO
HO
** 7-дегидрохолестерин.
Содерж-ся в жире морских рыб и жив-ых, а также липидов кожи ч-ка, под действ.УФ превращ-ся в вит.Д3.
CH3

 CH3 С Д
У Ф
CH3 С Д
У Ф
 А В
А В

 HO
HO
У Ф
 CH3
CH3
CH2
HO
Вит.Д3 (холикальциферол) кольцо В размыкается.
** эргостерин.
22 CH3
 24
24-метилхолистатрин-5,7,22-ол-3-β
24
24-метилхолистатрин-5,7,22-ол-3-β
CH3 23
CH3
 H H У
Ф
H H У
Ф
HO
CH3
CH3 вит.Д2(эргохальциферол)
HO
В молекулах Д2 возможно свободное вращение вокруг δ-св С6 и С7, при этом обр-ся 2 конфомера.
CH3 R

8 7
H 6 H
5
CH2
 3 1
3 1
HO 2
 CH3
R
CH3
R
CH2



 Происх.отталкив.гр.СН2
у С19 и кольца С.
Происх.отталкив.гр.СН2
у С19 и кольца С.
HO
Агликоны сердечных гликозидов.
Серд.гликозиды сод-ся в разл.вида напестянки, горицвете, весеннем, ландыше майском, стропанте и др.
В больш.дозах-яд.в-ва, а весьма малых-кардиотоническое действие.
По хим.структуре серд.гликозиды предст. О-гликозиды, в мол.α-ых агликон им.стериодную структуру, а углеродный фрагмент предств.остатками моно-ди-, тритетрасахарида.
Карденалиды
1) дигитоксичегенин( 3-β-14-β-дигидрокси-5β-карден-20(22)-алид.
 O
O
=O
CH3
CH3 Н c д
а в Н OH
HO H
Содерж-ся в структурх дигитоксина: ланатозида А гликозиды наперстянки особен.строениея:
1. цис- сочлен.колец С и Д.
2.А/В – цис-сочленение.
3. в 17 полож.нах-ся ненасыщ. Γ-лактонное кольцо.
2 ) строфантидин – гинин строфантина, гликрозида стропанта. У С10 нах-ся С=O вместо CH3
H
O
=O
 O CH3
O CH3
 C-H
C-H
OH

 HO
HO
OH
3β, 5β, 14β- тригидрокси-5β-карден-20(22)-олид-10 аль.
3β, 5β, 14β- тригидрокси-19-оксо-5β-карден-20(22)-алид.
Гинины, содерж-ие 5-членное γ-лактонное кольцо-относят.к кардинолидам (23ат.С)
Гинины, с 6-членнам 5-лактонным кольцом с 2-мя=связями гуфодиенолиды.
Гинины, с остатками углеводов соед-ся ч/з гидроксил у С3 и связь яв-ся β-гликозидной.
O
O
 CH3
CH3
 CH3
CH3



RO
Углеводы, входящие в состав сердечн.гликозидов.
** Д-дигитоксоза. Д-дигиталоза. Д-цимартоза.
 С=O
C=O
C=O
С=O
C=O
C=O
H H H
 CH2
H-C-OCH3
CH2
CH2
H-C-OCH3
CH2
H -C-OH H -C-OH H-C-OCH3
H
 -C-OH
H
-C-OH
H-C-OH
-C-OH
H
-C-OH
H-C-OH
H -C-OH H -C-OH H-C-OH
CH3 CH3 CH3
Пример серд.гликолиза наперстянки:
Д
 игитоксин
O
игитоксин
O
 =O
=O

 CH3
CH3
CH3
OH агликон дегитоксигенин
H CH3 O H CH3 O H CH3 O O
H
H H H O H H H O H H
HO OH H OH H OH H
Хим.св-ва стероидов.
** непредельность
1.качеств.обнаружение = связей
а) обесцвеч.(Br2) бромной воды
холистерин







 СН3
СН3
СН3
СН3
 A B + Br2
AE A В
A B + Br2
AE A В








 Br Br
Br Br
б) обесцвеч.р-ра КMnO4
СН3 СН3
A B + [O] KMnO4 A В
+ H2O –MnO2 OHOH
в) ароматич.кольцо с Br2 – идет замещение.
Эстрадиол.

 Br
Br
 + 2Br2
SE A В + 2HBr
+ 2Br2
SE A В + 2HBr
 HO Br
HO Br
2.гидрирование
Холистерин 2 [H] дигидрохолестерин
R
CH3
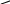
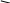 CН3
CН3
HO А В
Копростерин
А/В – цис
R
CH3
CН3 с д
HO А В
Н
3β-холестановая
А/В-транс
Эргостерин
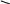

 + 2[H ]
+ 2[H ]
HO
 2[H ]
2[H ]
(1,4-присоед.к сопряж.части)
HO

+ 2[H ]
 HO
HO
+ 2[H ]
HO
** реак.по гидроксильной группе
а) спиртовая –OH
- на кисл.св-ва ( с щелоч Ме)
- реак. SN





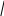
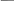

 А + HCl Cl
А + HCl Cl
H

 O
-H2O
А
O
-H2O
А
Н
Вторичный спирт

( е)
OH А
е)
OH А

 H
H
Hal занимает экваториальное положение. Механизм SN2 затруднен из-за жесткой циклич.системы в р-те реак.конф.сох-ся
-образов.сложн.эфиров.



 O
холистеридин
O
холистеридин




 А + R-C=O
CO +
НСl
А + R-C=O
CO +
НСl
HO Cl R
-обр-ие простых эфиров
-окисление
Вторич.спирты окисл-ся до кетонов.
Эстрадиол.
OH O

 + [O]
+ [O]


HO HO
б) фенольный –OH
- кисл.св-ва ( Na? NaOH)
-в щелоч.среде


 +RJ
+RJ


 Прост.
+NaJ
Прост.
+NaJ
эфиры 
 RO
RO
NaO


 R-С=O
O
R-С=O
O
 Cl
R-CO + NaCl
Cl
R-CO + NaCl
Сл.эфиры
- качеств.обнаружение ( +FeCl3) фиолетовое окрашевание.
** реакц.способность карбонильной группы.
-восстановление до спиртов
-нуклефильное присоединение ( AN)
а) HCN
б) NaHSO3
в) R-OH
- реак.присоединения-отщепления.
а) NH2-NH2- гидрацин
б) C6H5–NH–NH2
в) NH2–OH
 O
O
г) NH2–NH–C–NH2
** по карбоксильной группе
-кисл.св-ва
-р-им SN
а) Hal ангидриды
б) амиды ( гликохол и таурохол к-т)
в) сложн.эфиры.
** реак.по лактонному кольцу.
Это кольцо легко раскрыв-ся в щелочной среде.

 O
O




 =O HO COONa
=O HO COONa



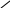
 + NaOH
+ NaOH
Д
