
- •Электронное оглавление
- •Капсулы (вставки)
- •ПРЕДИСЛОВИЕ
- •Часть I. ФИЗИЧЕСКИЕ ОСНОВЫ СТРОЕНИЯ МАТЕРИАЛЬНОГО МИРА
- •Глава 1. ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ЕСТЕСТВОЗНАНИИ
- •Владимир Иванович Вернадский
- •1.1. Этапы развития и становления естествознания
- •1.1.1. Программа Платона
- •1.1.2. Представления Аристотеля
- •1.1.3. Модель Демокрита
- •1.2. Проблемы естествознания на пути познания мира
- •1.2.1. Физический рационализм
- •1.2.2. Методы познания
- •Эрнест Резерфорд
- •1.2.3. Целостное восприятие мира
- •1.2.4. Физика и восточный мистицизм
- •1.2.5. Взаимосвязь естественных и гуманитарных наук
- •Вернер Гейзенберг
- •1.2.6. Синергетическая парадигма
- •1.2.7. Универсальный принцип естествознания — принцип дополнительности Бора
- •Нильс Бор
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 2. МЕХАНИКА ДИСКРЕТНЫХ ОБЪЕКТОВ
- •2.1. Трехмерность пространства
- •2.2. Пространство и время
- •Исаак Ньютон
- •Рис. 2.1. Изображение мировой линии в пространственно-временной системе отсчета
- •2.3. Особенности механики Ньютона
- •2.4. Движение в механике
- •2.5. Законы Ньютона — Галилея
- •2.6. Законы сохранения
- •2.7. Принципы оптимальности
- •2.8. Механическая картина мира
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 3. ФИЗИКА ПОЛЕЙ
- •3.1. Определение понятия поля
- •Рис. 3.1. Модель силовых линий поля.
- •3.2. Законы Фарадея — Максвелла для электромагнетизма
- •3.3. Электромагнитное поле
- •3.4. Гравитационное поле
- •3.5. Электромагнитная картина мира
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 4. ТЕОРИЯ ОТНОСИТЕЛЬНОСТИ ЭЙНШТЕЙНА — МОСТ МЕЖДУ МЕХАНИКОЙ И ЭЛЕКТРОМАГНЕТИЗМОМ
- •4.1. Физические начала специальной теории относительности (СТО)
- •А. Эйнштейн
- •4.1.1. Постулаты А. Эйнштейна в СТО
- •4.1.2. Принцип относительности Г. Галилея
- •Рис. 4.2. Преобразование Галилея х'= х— vt связывает положение тела Ρ в системах отсчета К и К'.
- •Рис. 4.3. Изменение электромагнитных сил в неподвижной К и подвижной К' системах отсчета.
- •4.1.3. Теория относительности и инвариантность времени
- •4.1.4. Постоянство скорости света
- •Рис. 4.5. «Поезд Эйнштейна»
- •4.1.5. Преобразования Г. Лоренца
- •4.1.6. Изменение длины и длительности времени в СТО
- •Рис. 4.6. Сокращение длины отрезка в направлении перемещения для системы, движущейся со скоростью ν ≈ с.
- •4.1.7. «Парадокс близнецов»
- •4.1.8. Изменение массы в СТО
- •4.2. Общая теория относительности (ОТО)
- •4.2.1. Постулаты ОТО
- •4.2.2. Экспериментальная проверка ОТО
- •Рис. 4.7. Отклонение световых лучей от звезды S при прохождении около Солнца от прямолинейной траектории.
- •4.2.3. Гравитация и искривление пространства
- •Рис. 4.8. Движение субъектов А и В с экватора точно на север по параллельным траекториям.
- •4.2.4. Основные итоги основ теории относительности
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 5. ОСНОВЫ КВАНТОВОЙ МЕХАНИКИ И КВАНТОВОЙ ЭЛЕКТРОДИНАМИКИ
- •5.1. Описание процессов в микромире
- •Первое.
- •Второе.
- •5.2. Необходимость введения квантовой механики
- •Эрвин Шрёдингер
- •абсолютно черное тело
- •корпускулярно-волновой дуализм
- •Луи де Бройль
- •5.3. Гипотеза Планка
- •Макс Планк
- •5.4. Измерения в квантовой механике
- •5.5. Волновая функция и принцип неопределенности В. Гейзенберга
- •Вольфганг Паули
- •5.6. Квантовая механика и обратимость времени
- •5.7. Квантовая электродинамика
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 6. ФИЗИКА ВСЕЛЕННОЙ
- •6.1. Космологическая модель А. Эйнштейна — A.A. Фридмана
- •6.2. Другие модели происхождения Вселенной
- •6.2.1. Модель Большого Взрыва
- •Георгий Антонович Гамов
- •6.2.2. Реликтовое излучение
- •6.2.3. Расширяется или сжимается Вселенная?
- •6.2.4. Сценарий развития Вселенной после Большого Взрыва
- •Рис. 6.1. Схема физической истории Вселенной.
- •6.2.5. Модель раздувающейся Вселенной
- •6.3. Современные представления об элементарных частицах как первооснове строения материи Вселенной
- •Поль Дирак
- •6.3.1. Классификация элементарных частиц
- •Рис. 6.2. Схема классификации элементарных частиц.
- •6.3.2. Кварковая модель
- •Таблица 6.1
- •Таблица 6.2
- •Таблица 6.3
- •6.4. Фундаментальные взаимодействия и мировые константы
- •6.4.1. Мировые константы
- •6.4.2. Фундаментальные взаимодействия и их роль в природе
- •6.4.3. Из чего же состоит вещество Вселенной?
- •Рис. 6.3. Возможные формы стабильной материи во Вселенной
- •6.4.4. Черные дыры
- •6.5. Модель единого физического поля и многомерность пространства—времени
- •6.5.1. Возможность многомерности пространства
- •Рис. 6.4. Модель трехмерного частотного пространства (ОД — оптический диапазон, видимая часть спектра, УФ — ультрафиолетовая, ИК — инфракрасная).
- •6.6. Устойчивость Вселенной и антропный принцип
- •6.6.1. Множественность миров
- •Рис. 6.5. Схематическое изображение областей, соответствующих устойчивым областям Вселенной.
- •6.6.2. Иерархичность структуры Вселенной
- •Рис. 6.6. Масштабы Вселенной
- •Рис. 6.7. Масштабы микромира
- •6.7. Антивещество во Вселенной и антигалактики
- •6.8. Механизм образования и эволюции звезд
- •Рис. 6.8. Схематическое изображение протон-протонной цепочки.
- •6.8.2. Углеродо-азотный цикл
- •6.8.3. Эволюция звезд
- •Рис. 6.10. Диаграмма эволюции звезд населения I.
- •6.8.4. Пульсары
- •Рис. 6.11. Модель пульсара, предложенная Голдом.
- •6.8.5. Квазары
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 7. ПРОБЛЕМА «ПОРЯДОК—БЕСПОРЯДОК» В ПРИРОДЕ И ОБЩЕСТВЕ. СИНЕРГЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ
- •7.1. Неравновесная термодинамика и синергетика
- •7.2. Динамика хаоса и порядка
- •7.3. Модель Э. Лоренца
- •7.4. Диссипативные структуры
- •7.6. Реакции Белоусова — Жаботинского
- •7.7. Динамический хаос
- •7.8. Фазовое пространство
- •7.9. Аттракторы
- •Рис. 7.1. Изображение аттракторов на фазовых диаграммах.
- •Рис. 7.2. Бифуркационная диаграмма (А — характеристика системы, λ — управляющий параметр).
- •7.10. Режим с обострением
- •7.11. Модель Пуанкаре описания изменения состояния системы
- •7.12. Динамические неустойчивости
- •7.13. Изменение энергии при эволюции системы
- •7.14. Гармония хаоса и порядка и «золотое сечение»
- •Леонардо да Винчи
- •7.15. Открытые системы
- •7.16. Принцип производства минимума энтропии
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 8. СИММЕТРИЯ И АСИММЕТРИЯ В РАЗЛИЧНЫХ ФИЗИЧЕСКИХ ПРОЯВЛЕНИЯХ
- •8.1. Симметрия и законы сохранения
- •8.2. Симметрия—асимметрия
- •8.3. Закон сохранения электрического заряда
- •8.4. Зеркальная симметрия
- •8.5. Другие виды симметрии
- •8.6. Хиральность живой и неживой природы
- •Рис. 8.1. Зеркальная симметрия молекул воды (а) и бутилового спирта (б).
- •8.7. Симметрия и энтропия
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 9. СОВРЕМЕННАЯ ЕСТЕСТВЕННО-НАУЧНАЯ КАРТИНА МИРА С ПОЗИЦИИ ФИЗИКИ
- •9.1. Классификация механик
- •Рис. 9.1. Куб фундаментальных физических теорий.
- •9.2. Современная физическая картина мира
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Часть II. ФИЗИКА ЖИВОГО И ЭВОЛЮЦИЯ ПРИРОДЫ И ОБЩЕСТВА
- •Глава 10. ОБЩИЕ ПРОБЛЕМЫ ФИЗИКИ ЖИВОГО
- •Глава 11. ОТ ФИЗИКИ СУЩЕСТВУЮЩЕГО К ФИЗИКЕ ВОЗНИКАЮЩЕГО
- •11.1. Термодинамические особенности развития живых систем
- •11.1.1. Роль энтропии для живых организмов
- •11.1.2. Неустойчивость как фактор развития живого
- •11.2. Энергетический подход к описанию живого
- •11.2.1. Устойчивое неравновесие
- •11.3. Уровни организации живых систем и системный подход к эволюции живого
- •11.3.1. Иерархия уровней организации живого
- •11.3.2. Метод Фибоначчи как фактор гармонической самоорганизации
- •11.3.3. Физический и биологический методы изучения природы живого
- •11.3.4. Антропный принцип в физике живого
- •11.3.5. Физическая эволюция Л. Больцмана и биологическая эволюция Ч. Дарвина
- •11.4. Физическая интерпретация биологических законов
- •11.4.1. Физические модели в биологии
- •11.4.2. Физические факторы развития живого
- •11.5. Пространство и время для живых организмов
- •11.5.1. Связь пространства и энергии для живого
- •11.5.2. Биологическое время живой системы
- •11.5.3. Психологическое время живых организмов
- •11.6. Энтропия и информация в живых системах
- •11.6.1. Ценность информации
- •11.6.2. Кибернетический подход к описанию живого
- •11.6.3. Роль физических законов в понимании живого
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА:
- •Глава 12. ФИЗИЧЕСКИЕ АСПЕКТЫ И ПРИНЦИПЫ БИОЛОГИИ
- •12.1. От атомов к протожизни
- •12.1.1. Гипотезы происхождения жизни
- •12.1.2. Необходимые факторы возникновения жизни
- •12.1.3. Теория абиогенного происхождения жизни А.И. Опарина
- •12.1.4. Гетеротрофы и автотрофы
- •12.2. Химические процессы и молекулярная самоорганизация
- •12.2.1. Химические понятия и определения
- •Рис. 12.1. Схема изменения свободной энергии и химической связи в молекулах живых организмов.
- •12.2.2. Аминокислоты
- •12.2.3. Теория химической эволюции в биогенезе
- •12.2.4. Теория молекулярной самоорганизации М. Эйгена
- •12.2.5. Циклическая организация химических реакций и гиперциклы
- •12.3. Биохимические составляющие живого вещества
- •12.3.1. Молекулы живой природы
- •12.3.2. Мономеры и макромолекулы
- •12.3.3. Белки
- •Рис. 12.2. Структура белка-миоглобина.
- •Рис. 12.3. Структуры 20 аминокислот, встречающихся в белках.
- •12.3.4. Нуклеиновые кислоты
- •Рис. 12.4. Строение нуклеотида — мономера нуклеиновых кислот.
- •Рис. 12.5. Двойная спираль молекулы ДНК.
- •Рис. 12.6. Построение нуклеиновой кислоты из нуклеотидов.
- •12.3.5. Углеводы
- •Рис. 12.7. Структура АТФ.
- •Рис. 12.8. Схема получения свободной энергии с участием АТФ.
- •Рис. 12.9. Схема образования молекулы АТФ.
- •Рис. 12.10. Схема цикла Липмана по участию молекул фосфора в энергетических процессах живого организма.
- •12.3.6. Липиды
- •Рис. 12.11. Структура ненасыщенных (а) и насыщенных (б) жирных кислот.
- •Рис. 12.12. Растворение ионного конца жирной кислоты в воде.
- •Рис. 12.13. Растворение углеводородных цепей мыла в масле.
- •12.3.7. Роль воды для живых организмов
- •12.4. Клетка как элементарная частица молекулярной биологии
- •12.4.1. Строение клетки
- •Рис. 12.14. Строение клетки.
- •12.4.2. Процессы в клетке
- •12.4.3. Клеточные мембраны
- •12.4.4. Фотосинтез
- •12.4.5. Деление клеток и образование организма
- •Рис. 12.15. Клеточный цикл.
- •12.5. Роль асимметрии в возникновении живого
- •12.5.1. Оптическая активность вещества и хиральность
- •12.5.2. Гомохиральность и самоорганизация в живых организмах
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 13. ФИЗИЧЕСКИЕ ПРИНЦИПЫ ВОСПРОИЗВОДСТВА И РАЗВИТИЯ ЖИВЫХ СИСТЕМ
- •13.1. Информационные молекулы наследственности
- •13.1.1. Генетический код
- •13.1.2. Гены и квантовый мир
- •Иерархия и сопоставление элементов в физическом и генетическом атомизме
- •13.2. Воспроизводство и наследование признаков
- •13.2.1. Генотип и фенотип
- •Геном
- •Генофонд
- •13.2.2. Законы генетики Г. Менделя
- •13.2.3. Хромосомная теория наследственности
- •13.3. Процессы мутагенеза и передача наследственной информации
- •13.3.1. Мутации и радиационный мутагенез
- •Николай Владимирович Тимофеев-Ресовский
- •13.3.2. Мутации и развитие организма
- •13.4. Матричный принцип синтеза информационных макромолекул и молекулярная генетика
- •13.4.1. Передача наследственной информации через репликации
- •Рис. 13.1. Репликация ДНК.
- •13.4.2. Матричный синтез путем конвариантной редупликации
- •13.4.3. Транскрипция
- •13.4.4. Трансляция
- •Рис. 13.2. Схема биосинтеза белков.
- •Рис. 13.3. Основные этапы процесса передачи генетической информации.
- •13.4.5. Отличия белков и нуклеиновых кислот
- •13.4.6. Новый механизм передачи наследственной информации и прионные болезни
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 14. ФИЗИЧЕСКОЕ ПОНИМАНИЕ ЭВОЛЮЦИОННОГО И ИНДИВИДУАЛЬНОГО РАЗВИТИЯ ОРГАНИЗМОВ
- •14.1. Онтогенез и филогенез. Онтогенетический и популяционный уровни организации жизни
- •14.1.1. Закон Геккеля для онтогенеза и филогенеза
- •14.1.2. Онтогенетический уровень жизни
- •14.1.3. Популяции и популяционно-видовой уровень живого
- •14.2. Физическое представление эволюции
- •14.2.1. Синтетическая теория эволюции
- •14.2.2. Эволюция популяций
- •14.2.3. Элементарные факторы эволюции
- •14.2.4. Живой организм в индивидуальном и историческом развитии
- •14.2.5. Геологическая эволюция и общая схема эволюции Земли по H.H. Моисееву
- •14.3. Аксиомы биологии
- •14.3.1. Первая аксиома
- •14.3.2. Вторая аксиома
- •14.3.3. Третья аксиома
- •14.3.4. Четвертая аксиома
- •14.3.5. Физические представления аксиом биологии
- •14.4. Признаки живого и определения жизни
- •14.4.1. Совокупность признаков живого
- •14.4.2. Определения жизни
- •14.5. Физическая модель демографического развития СП. Капицы
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 15. ФИЗИЧЕСКИЕ И ИНФОРМАЦИОННЫЕ ПОЛЯ БИОЛОГИЧЕСКИХ СТРУКТУР
- •15.1. Физические поля и излучения функционирующего организма человека
- •Рис. 15.1. Схема физических полей в организме человека
- •15.1.1. Электромагнитные поля и излучения живого организма
- •Рис. 15.2. Распределение вокруг человека электрического поля, образующегося в результате биоэлектрической активности его сердца.
- •15.1.2. Тепловое и другие виды излучений
- •15.2. Механизм взаимодействия излучений человека с окружающей средой
- •15.2.1. Электромагнитное и ионизирующее излучения
- •15.2.2. Возможности медицинской диагностики и лечения на основе излучений из организма человека
- •15.3. Устройство памяти. Воспроизводство и передача информации в организме
- •15.3.1. Физические процессы передачи информационного сигнала в живом организме
- •Рис. 15.3. Строение нейрона.
- •Рис. 15.4. Электрический потенциал действия нервного импульса.
- •15.3.2. Физическая основа памяти
- •15.3.3. Человеческий мозг и компьютер
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 16ю ФИЗИЧЕСКИЕ АСПЕКТЫ БИОСФЕРЫ И ОСНОВЫ ЭКОЛОГИИ
- •16.1. Структурная организованность биосферы
- •16.1.1. Биоценозы
- •16.1.2. Геоценозы и биогеоценозы. Экосистемы
- •16.1.3. Понятие биосферы
- •16.1.4. Биологический круговорот веществ в природе
- •16.1.5. Роль энергии в эволюции
- •Рис. 16.1. Распределение солнечной энергии, поступающей на Землю.
- •16.2. Биогеохимические принципы В.И. Вернадского и живое вещество
- •16.2.1. Живое вещество
- •16.2.2. Биогеохимические принципы В.И. Вернадского
- •16.3. Физические представления эволюции биосферы и переход к ноосфере
- •16.3.1. Основные этапы эволюции биосферы
- •16.3.2. Ноосфера
- •16.3.3. Преобразование биосферы в ноосферу
- •16.4. Физические факторы влияния Космоса на земные процессы
- •Рис. 16.2. Общая схема солнечно-земных связей.
- •Рис. 16.3. Взаимодействие заряженных частиц от Солнца с магнитным полем Земли.
- •16.4.1. Связь Космоса с Землей по концепции А.Л. Чижевского
- •Александр Леонидович Чижевский
- •16.5. Физические основы экологии
- •16.5.1. Увеличение антропогенной нагрузки на окружающую среду
- •16.5.2. Физические принципы ухудшения экологии
- •16.6. Принципы устойчивого развития
- •16.6.1. Оценки устойчивости биосферы
- •16.6.2. Концепция устойчивого развития и необходимость экологического образования
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 17. ФИЗИЧЕСКИЕ МОДЕЛИ САМООРГАНИЗАЦИИ В ЭКОНОМИКЕ
- •17.1. Экономическая модель длинных волн Н. Д. Кондратьева
- •17.2. Обратимость и необратимость процессов в экономике
- •17.3. Синергетические представления устойчивости в экономике
- •17.4. Физическое моделирование рынка
- •17.5. Циклический характер экономических процессов в модели Н.Д. Кондратьева
- •17.6. Модель колебательных процессов в экономике
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •ЛИТЕРАТУРА
- •Основная
- •Дополнительная
- •ТЕМЫ КУРСОВЫХ РАБОТ, РЕФЕРАТОВ И ДОКЛАДОВ
- •ВОПРОСЫ К ЗАЧЕТУ И ЭКЗАМЕНУ
- •СЛОВАРЬ ТЕРМИНОВ
- •ЛИТЕРАТУРА
- •СОДЕРЖАНИЕ
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
187 |
Процесс строительства биомолекул из мономеров обратим: макромолекулы могут разлагаться до мономеров, что происходит, например, в желудочно-кишечном тракте животных. Биомолекулы пищи распадаются до молекул-мономеров, которые затем всасываются в кровь и используются живым организмом для создания тех макромолекул, которые нужны именно этому организму.
Вбиохимии особую роль играют три класса малых молекул-мономеров: аминокислоты, нуклеотиды и моносахариды. Они служат теми «кирпичиками», из которых затем строятся полимерные биологические макромолекулы — белки, нуклеиновые кислоты и полисахариды. Размер мономеров 0,5 — 1 нм, в то время как макромолекулы достигают размеров от 3 до 300 нм. Диаметр атомов углерода, кислорода, азота и водорода, из которых в основном и состоят биологические молекулы, составляет около 0,4 нм; диаметр молекулы аминокислоты — 0,5 нм; диаметр небольшого белкового образования — 4 нм, хромосомы ~ 1 нм. Однако атомы в 100000 раз меньше клетки, а диаметр клетки в 100000 раз меньше человеческого роста. Английский ученый Дж. Кендрю [64] приводит такое сравнение: если увеличить дождевую каплю до размеров земного шара, то атом будет размером с человека, а его ядро — размером с бактерию.
Вдополнение к рис. 6.8 и 6.9 по масштабам макро- и микромира можно привести для сравнения характерные размеры и других объектов. Толщина человеческого волоса 0,1 мм, расстояние до линии горизонта на уровне моря 4 км, окружность эква-
315
тора Земли 40000 км, расстояние до Луны всего в 10 раз больше экватора — 400000 км, до Солнца 1,5 · 108 км. Радиус Вселенной предполагают равным от 8 · 109 до 2 · 1010 световых лет.
Исходя из атомных характеристик можно объяснить поведение и малых, и больших макромолекул. Органеллы, клетки и живые организмы являются просто совокупностями макромолекул. Применяя методы статистического описания элементарных единиц жизни на квантовом уровне, можно попробовать описать жизненные процессы как поведение атомов в рамках синергетического подхода. В этом смысле жизнь определяет квантовомеханическая динамика атомной структуры вещества живого организма.
Все живые организмы содержат четыре основных класса органических веществ — белки, нуклеиновые кислоты, углеводы и липиды. Рассмотрим кратко эти классы биополимеров.
12.3.3. Белки
Широкий диапазон выполняемых белками функций находит свое отражение в разнообразии их химических структур и пространственных форм. На рис. 12.2 показана структура белка — миоглобина, который содержится в мышцах животных и человека. Белковая цепь миоглобина свернута таким образом, что несколько отдельных ее участков оказываются сближенными в пространстве и формируют центр для образования гема (он на рисунке показан черным) — железосодержащую группу, способную присоединить кислород. Следует особенно подчеркнуть роль белков в организации живого вещества. Белки представляют собой полипептидные последовательности 20 стандартных аминокислот. Синтез белка осуществляется путем последовательной
поликонденсации отдельных аминокислотных остатков, от амино (N) конца полипептидной цепи к ее карбоксильному (С) концу.
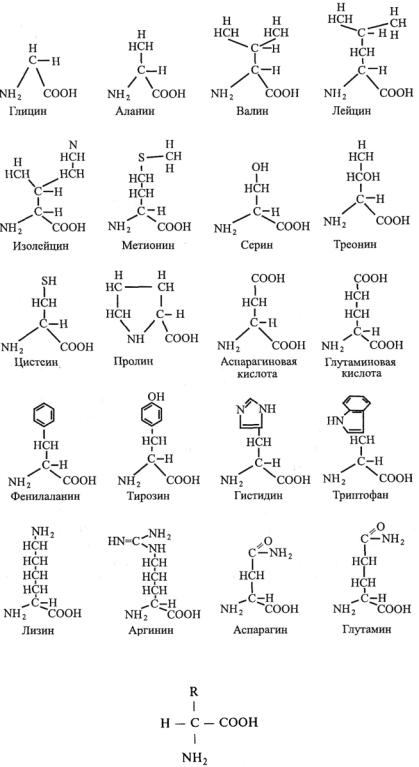
Карбоксильная группа (—COOH) и амино-группа (—NH2) каждой из аминокислот присоединяется к одному и тому же атому углерода С. К этому же атому С присоединится и одна из многих возможных боковых групп, образуя ту или иную аминокислоту (рис. 12.3). Из этого рисун-
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
188 |
Рис. 12.2. Структура белка-миоглобина.
316
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
189 |
Рис. 12.3. Структуры 20 аминокислот, встречающихся в белках.
317
ка видно, что все они, за исключением пролина, имеют одинаковую основу и отличаются только строением боковой группы R:
Все используемые организмом в белках 20 аминокислот различаются этими присоединенными атомами или соединениями. В организме человека синтезируется 12 аминокислот, 8 должны поступать с пищей. Всего в клетках и тканях может содержаться до 170 аминокислот. Таким образом, аминокислоты являются для макромолекулы белка мономерами. Белок, содержащий тысячи аминокислот, синтезируется в живой клетке за 5
—6 мин.
Свойства белков определяются пространственной трехмерной структурой их цепей.
Такая пространственная форма очень чувствительна к температуре окружающей среды. При повышении температуры белок денатурируется — теряет свою пространственную конфигурацию, а вместе с ней и биологические свойства. У живых организмов это происходит при температуре около 60 °С. Эти белковые цепи могут самопроизвольно свертываться в строго определенные структуры, геометрия и динамика которых
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
190 |
определяется составом и порядком аминокислотных остатков в цепи. Поскольку синтезирующиеся полимеры находятся в водном растворе организма в виде статистического клубка, то они не образуют стабильных и идентичных для всех макромолекул трехмерных структур. Функциональность и специфичность белка зависит от генетического кода ДНК и исполнения его в РНК.
Белки — строительный материал в живой природе. В них преобразуется тепловая энергия хаотического движения в энергию более высокого порядка — механическую и энергию стереоспецифических внутримолекулярных взаимодействий. Если в неживой природе тепловая энергия рассеивается при установлении равновесия, то роль белков в живой природе заключается в преобразовании тепловой энергии хаоса в нужные для развития и функционирования живого организма виды энергии. Поэтому белки обладают способностью взаимопревращения всех необходимых для жизни энергий (тепловой, механической, химиче-
318
ской, световой), а также уникальной способностью зарождения из хаоса упорядоченной структуры молекул живого организма.
Эта способность и обусловлена их пространственной химической структурой. Причем белок может иметь первичную, вторичную, третичную и четвертичную структуры. Под первичной понимают химическую, структурную формулу белка, представленную в виде линейной последовательности аминокислотных остатков и определяющую порядок их чередования. Остальные структуры — это различные уровни этой линейной последовательности в пространстве. Вторичная структура представляет собой спираль, в которой отдельные аминокислоты соединены водородной связью, третичная образует клубок (глобулу) из белка одной природы, а четвертичная — клубок из белковых глобул, различных по своей природе и структуре.
Взаимодействие между отдельными участками цепи определяется характером химической связи (водородной, ковалентной, ионной) и ранее рассмотренной последовательностью расположения аминокислот в полипептидной цепи. После соединения аминокислот в определенной последовательности цепь автоматически закручивается, образует петли и свертывается в присущую ей правильную структуру, т.е. происходит самосборка белковых молекул в трехмерном пространстве. Если многократно растягивать полипептидную связь и затем отпускать, то она всегда будет восстанавливаться в присущую для каждого вида цепи структуру.
Изменяя в цепи лишь одну аминокислоту, можно получить молекулу с совершенно другой структурой и иными свойствами. Цепь длиной уже в 1000 звеньев открывает безграничные возможности формирования таких свойств белка, которые полностью отсутствуют в каждой отдельной молекуле. Огромное разнообразие живых организмов на Земле в основном определяется различиями в составе и пространственной форме составляющих их белков. Например, глобулярные белки принимают участие в катализе, транспорте, регуляции, а фибилярные белки (коллаген, кератин и фиброин шелка) играют структурную роль. Коллаген — наиболее распространенный белок у млекопитающих — образует основу сухожилий, костей, кожи и хрящей. Структурной единицей коллагенового волокна является тропо-коллагеновая молекула, состоящая из трех полипептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков. Белки-глобины участвуют в переносе кислорода.
319
Глобулярный белок — гемоглобин — входит в состав красных клеток крови — эритроцитов, обусловливает красный цвет крови и обладает способностью связывать молекулярный кислород. Одна его молекула присоединяет к себе одновременно четыре молекулы кислорода. При этом в легких, где давление кислорода более высокое, происходит присоединение кислорода к гемоглобину, в тканях, где давление более низкое, кислород освобождается и происходит его диффузия в клетки. В клетке кислород взаимодействует с белком — миоглобином, который тоже может связывать кислород, но только одну его молекулу. Таким образом, молекулы кислорода переходят от гемоглобина к миоглобину и хранятся там до тех пор, пока они не потребуются. Миоглобин тоже красного цвета и придает красный цвет мясу.
Все биосистемы содержат белки, которые отвечают за фундаментальные свойства живого: разнообразие его органического мира, избирательность и эффективность процессов жизнедеятельности, целесообразность форм организмов, самоорганизацию живой материи; они — активное начало жизни. В чистом виде белок является веществом белого цвета или бесцветным, что и определяет его название.
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
