
- •Электронное оглавление
- •Капсулы (вставки)
- •ПРЕДИСЛОВИЕ
- •Часть I. ФИЗИЧЕСКИЕ ОСНОВЫ СТРОЕНИЯ МАТЕРИАЛЬНОГО МИРА
- •Глава 1. ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ЕСТЕСТВОЗНАНИИ
- •Владимир Иванович Вернадский
- •1.1. Этапы развития и становления естествознания
- •1.1.1. Программа Платона
- •1.1.2. Представления Аристотеля
- •1.1.3. Модель Демокрита
- •1.2. Проблемы естествознания на пути познания мира
- •1.2.1. Физический рационализм
- •1.2.2. Методы познания
- •Эрнест Резерфорд
- •1.2.3. Целостное восприятие мира
- •1.2.4. Физика и восточный мистицизм
- •1.2.5. Взаимосвязь естественных и гуманитарных наук
- •Вернер Гейзенберг
- •1.2.6. Синергетическая парадигма
- •1.2.7. Универсальный принцип естествознания — принцип дополнительности Бора
- •Нильс Бор
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 2. МЕХАНИКА ДИСКРЕТНЫХ ОБЪЕКТОВ
- •2.1. Трехмерность пространства
- •2.2. Пространство и время
- •Исаак Ньютон
- •Рис. 2.1. Изображение мировой линии в пространственно-временной системе отсчета
- •2.3. Особенности механики Ньютона
- •2.4. Движение в механике
- •2.5. Законы Ньютона — Галилея
- •2.6. Законы сохранения
- •2.7. Принципы оптимальности
- •2.8. Механическая картина мира
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 3. ФИЗИКА ПОЛЕЙ
- •3.1. Определение понятия поля
- •Рис. 3.1. Модель силовых линий поля.
- •3.2. Законы Фарадея — Максвелла для электромагнетизма
- •3.3. Электромагнитное поле
- •3.4. Гравитационное поле
- •3.5. Электромагнитная картина мира
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 4. ТЕОРИЯ ОТНОСИТЕЛЬНОСТИ ЭЙНШТЕЙНА — МОСТ МЕЖДУ МЕХАНИКОЙ И ЭЛЕКТРОМАГНЕТИЗМОМ
- •4.1. Физические начала специальной теории относительности (СТО)
- •А. Эйнштейн
- •4.1.1. Постулаты А. Эйнштейна в СТО
- •4.1.2. Принцип относительности Г. Галилея
- •Рис. 4.2. Преобразование Галилея х'= х— vt связывает положение тела Ρ в системах отсчета К и К'.
- •Рис. 4.3. Изменение электромагнитных сил в неподвижной К и подвижной К' системах отсчета.
- •4.1.3. Теория относительности и инвариантность времени
- •4.1.4. Постоянство скорости света
- •Рис. 4.5. «Поезд Эйнштейна»
- •4.1.5. Преобразования Г. Лоренца
- •4.1.6. Изменение длины и длительности времени в СТО
- •Рис. 4.6. Сокращение длины отрезка в направлении перемещения для системы, движущейся со скоростью ν ≈ с.
- •4.1.7. «Парадокс близнецов»
- •4.1.8. Изменение массы в СТО
- •4.2. Общая теория относительности (ОТО)
- •4.2.1. Постулаты ОТО
- •4.2.2. Экспериментальная проверка ОТО
- •Рис. 4.7. Отклонение световых лучей от звезды S при прохождении около Солнца от прямолинейной траектории.
- •4.2.3. Гравитация и искривление пространства
- •Рис. 4.8. Движение субъектов А и В с экватора точно на север по параллельным траекториям.
- •4.2.4. Основные итоги основ теории относительности
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 5. ОСНОВЫ КВАНТОВОЙ МЕХАНИКИ И КВАНТОВОЙ ЭЛЕКТРОДИНАМИКИ
- •5.1. Описание процессов в микромире
- •Первое.
- •Второе.
- •5.2. Необходимость введения квантовой механики
- •Эрвин Шрёдингер
- •абсолютно черное тело
- •корпускулярно-волновой дуализм
- •Луи де Бройль
- •5.3. Гипотеза Планка
- •Макс Планк
- •5.4. Измерения в квантовой механике
- •5.5. Волновая функция и принцип неопределенности В. Гейзенберга
- •Вольфганг Паули
- •5.6. Квантовая механика и обратимость времени
- •5.7. Квантовая электродинамика
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 6. ФИЗИКА ВСЕЛЕННОЙ
- •6.1. Космологическая модель А. Эйнштейна — A.A. Фридмана
- •6.2. Другие модели происхождения Вселенной
- •6.2.1. Модель Большого Взрыва
- •Георгий Антонович Гамов
- •6.2.2. Реликтовое излучение
- •6.2.3. Расширяется или сжимается Вселенная?
- •6.2.4. Сценарий развития Вселенной после Большого Взрыва
- •Рис. 6.1. Схема физической истории Вселенной.
- •6.2.5. Модель раздувающейся Вселенной
- •6.3. Современные представления об элементарных частицах как первооснове строения материи Вселенной
- •Поль Дирак
- •6.3.1. Классификация элементарных частиц
- •Рис. 6.2. Схема классификации элементарных частиц.
- •6.3.2. Кварковая модель
- •Таблица 6.1
- •Таблица 6.2
- •Таблица 6.3
- •6.4. Фундаментальные взаимодействия и мировые константы
- •6.4.1. Мировые константы
- •6.4.2. Фундаментальные взаимодействия и их роль в природе
- •6.4.3. Из чего же состоит вещество Вселенной?
- •Рис. 6.3. Возможные формы стабильной материи во Вселенной
- •6.4.4. Черные дыры
- •6.5. Модель единого физического поля и многомерность пространства—времени
- •6.5.1. Возможность многомерности пространства
- •Рис. 6.4. Модель трехмерного частотного пространства (ОД — оптический диапазон, видимая часть спектра, УФ — ультрафиолетовая, ИК — инфракрасная).
- •6.6. Устойчивость Вселенной и антропный принцип
- •6.6.1. Множественность миров
- •Рис. 6.5. Схематическое изображение областей, соответствующих устойчивым областям Вселенной.
- •6.6.2. Иерархичность структуры Вселенной
- •Рис. 6.6. Масштабы Вселенной
- •Рис. 6.7. Масштабы микромира
- •6.7. Антивещество во Вселенной и антигалактики
- •6.8. Механизм образования и эволюции звезд
- •Рис. 6.8. Схематическое изображение протон-протонной цепочки.
- •6.8.2. Углеродо-азотный цикл
- •6.8.3. Эволюция звезд
- •Рис. 6.10. Диаграмма эволюции звезд населения I.
- •6.8.4. Пульсары
- •Рис. 6.11. Модель пульсара, предложенная Голдом.
- •6.8.5. Квазары
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 7. ПРОБЛЕМА «ПОРЯДОК—БЕСПОРЯДОК» В ПРИРОДЕ И ОБЩЕСТВЕ. СИНЕРГЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ
- •7.1. Неравновесная термодинамика и синергетика
- •7.2. Динамика хаоса и порядка
- •7.3. Модель Э. Лоренца
- •7.4. Диссипативные структуры
- •7.6. Реакции Белоусова — Жаботинского
- •7.7. Динамический хаос
- •7.8. Фазовое пространство
- •7.9. Аттракторы
- •Рис. 7.1. Изображение аттракторов на фазовых диаграммах.
- •Рис. 7.2. Бифуркационная диаграмма (А — характеристика системы, λ — управляющий параметр).
- •7.10. Режим с обострением
- •7.11. Модель Пуанкаре описания изменения состояния системы
- •7.12. Динамические неустойчивости
- •7.13. Изменение энергии при эволюции системы
- •7.14. Гармония хаоса и порядка и «золотое сечение»
- •Леонардо да Винчи
- •7.15. Открытые системы
- •7.16. Принцип производства минимума энтропии
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 8. СИММЕТРИЯ И АСИММЕТРИЯ В РАЗЛИЧНЫХ ФИЗИЧЕСКИХ ПРОЯВЛЕНИЯХ
- •8.1. Симметрия и законы сохранения
- •8.2. Симметрия—асимметрия
- •8.3. Закон сохранения электрического заряда
- •8.4. Зеркальная симметрия
- •8.5. Другие виды симметрии
- •8.6. Хиральность живой и неживой природы
- •Рис. 8.1. Зеркальная симметрия молекул воды (а) и бутилового спирта (б).
- •8.7. Симметрия и энтропия
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 9. СОВРЕМЕННАЯ ЕСТЕСТВЕННО-НАУЧНАЯ КАРТИНА МИРА С ПОЗИЦИИ ФИЗИКИ
- •9.1. Классификация механик
- •Рис. 9.1. Куб фундаментальных физических теорий.
- •9.2. Современная физическая картина мира
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Часть II. ФИЗИКА ЖИВОГО И ЭВОЛЮЦИЯ ПРИРОДЫ И ОБЩЕСТВА
- •Глава 10. ОБЩИЕ ПРОБЛЕМЫ ФИЗИКИ ЖИВОГО
- •Глава 11. ОТ ФИЗИКИ СУЩЕСТВУЮЩЕГО К ФИЗИКЕ ВОЗНИКАЮЩЕГО
- •11.1. Термодинамические особенности развития живых систем
- •11.1.1. Роль энтропии для живых организмов
- •11.1.2. Неустойчивость как фактор развития живого
- •11.2. Энергетический подход к описанию живого
- •11.2.1. Устойчивое неравновесие
- •11.3. Уровни организации живых систем и системный подход к эволюции живого
- •11.3.1. Иерархия уровней организации живого
- •11.3.2. Метод Фибоначчи как фактор гармонической самоорганизации
- •11.3.3. Физический и биологический методы изучения природы живого
- •11.3.4. Антропный принцип в физике живого
- •11.3.5. Физическая эволюция Л. Больцмана и биологическая эволюция Ч. Дарвина
- •11.4. Физическая интерпретация биологических законов
- •11.4.1. Физические модели в биологии
- •11.4.2. Физические факторы развития живого
- •11.5. Пространство и время для живых организмов
- •11.5.1. Связь пространства и энергии для живого
- •11.5.2. Биологическое время живой системы
- •11.5.3. Психологическое время живых организмов
- •11.6. Энтропия и информация в живых системах
- •11.6.1. Ценность информации
- •11.6.2. Кибернетический подход к описанию живого
- •11.6.3. Роль физических законов в понимании живого
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА:
- •Глава 12. ФИЗИЧЕСКИЕ АСПЕКТЫ И ПРИНЦИПЫ БИОЛОГИИ
- •12.1. От атомов к протожизни
- •12.1.1. Гипотезы происхождения жизни
- •12.1.2. Необходимые факторы возникновения жизни
- •12.1.3. Теория абиогенного происхождения жизни А.И. Опарина
- •12.1.4. Гетеротрофы и автотрофы
- •12.2. Химические процессы и молекулярная самоорганизация
- •12.2.1. Химические понятия и определения
- •Рис. 12.1. Схема изменения свободной энергии и химической связи в молекулах живых организмов.
- •12.2.2. Аминокислоты
- •12.2.3. Теория химической эволюции в биогенезе
- •12.2.4. Теория молекулярной самоорганизации М. Эйгена
- •12.2.5. Циклическая организация химических реакций и гиперциклы
- •12.3. Биохимические составляющие живого вещества
- •12.3.1. Молекулы живой природы
- •12.3.2. Мономеры и макромолекулы
- •12.3.3. Белки
- •Рис. 12.2. Структура белка-миоглобина.
- •Рис. 12.3. Структуры 20 аминокислот, встречающихся в белках.
- •12.3.4. Нуклеиновые кислоты
- •Рис. 12.4. Строение нуклеотида — мономера нуклеиновых кислот.
- •Рис. 12.5. Двойная спираль молекулы ДНК.
- •Рис. 12.6. Построение нуклеиновой кислоты из нуклеотидов.
- •12.3.5. Углеводы
- •Рис. 12.7. Структура АТФ.
- •Рис. 12.8. Схема получения свободной энергии с участием АТФ.
- •Рис. 12.9. Схема образования молекулы АТФ.
- •Рис. 12.10. Схема цикла Липмана по участию молекул фосфора в энергетических процессах живого организма.
- •12.3.6. Липиды
- •Рис. 12.11. Структура ненасыщенных (а) и насыщенных (б) жирных кислот.
- •Рис. 12.12. Растворение ионного конца жирной кислоты в воде.
- •Рис. 12.13. Растворение углеводородных цепей мыла в масле.
- •12.3.7. Роль воды для живых организмов
- •12.4. Клетка как элементарная частица молекулярной биологии
- •12.4.1. Строение клетки
- •Рис. 12.14. Строение клетки.
- •12.4.2. Процессы в клетке
- •12.4.3. Клеточные мембраны
- •12.4.4. Фотосинтез
- •12.4.5. Деление клеток и образование организма
- •Рис. 12.15. Клеточный цикл.
- •12.5. Роль асимметрии в возникновении живого
- •12.5.1. Оптическая активность вещества и хиральность
- •12.5.2. Гомохиральность и самоорганизация в живых организмах
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 13. ФИЗИЧЕСКИЕ ПРИНЦИПЫ ВОСПРОИЗВОДСТВА И РАЗВИТИЯ ЖИВЫХ СИСТЕМ
- •13.1. Информационные молекулы наследственности
- •13.1.1. Генетический код
- •13.1.2. Гены и квантовый мир
- •Иерархия и сопоставление элементов в физическом и генетическом атомизме
- •13.2. Воспроизводство и наследование признаков
- •13.2.1. Генотип и фенотип
- •Геном
- •Генофонд
- •13.2.2. Законы генетики Г. Менделя
- •13.2.3. Хромосомная теория наследственности
- •13.3. Процессы мутагенеза и передача наследственной информации
- •13.3.1. Мутации и радиационный мутагенез
- •Николай Владимирович Тимофеев-Ресовский
- •13.3.2. Мутации и развитие организма
- •13.4. Матричный принцип синтеза информационных макромолекул и молекулярная генетика
- •13.4.1. Передача наследственной информации через репликации
- •Рис. 13.1. Репликация ДНК.
- •13.4.2. Матричный синтез путем конвариантной редупликации
- •13.4.3. Транскрипция
- •13.4.4. Трансляция
- •Рис. 13.2. Схема биосинтеза белков.
- •Рис. 13.3. Основные этапы процесса передачи генетической информации.
- •13.4.5. Отличия белков и нуклеиновых кислот
- •13.4.6. Новый механизм передачи наследственной информации и прионные болезни
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 14. ФИЗИЧЕСКОЕ ПОНИМАНИЕ ЭВОЛЮЦИОННОГО И ИНДИВИДУАЛЬНОГО РАЗВИТИЯ ОРГАНИЗМОВ
- •14.1. Онтогенез и филогенез. Онтогенетический и популяционный уровни организации жизни
- •14.1.1. Закон Геккеля для онтогенеза и филогенеза
- •14.1.2. Онтогенетический уровень жизни
- •14.1.3. Популяции и популяционно-видовой уровень живого
- •14.2. Физическое представление эволюции
- •14.2.1. Синтетическая теория эволюции
- •14.2.2. Эволюция популяций
- •14.2.3. Элементарные факторы эволюции
- •14.2.4. Живой организм в индивидуальном и историческом развитии
- •14.2.5. Геологическая эволюция и общая схема эволюции Земли по H.H. Моисееву
- •14.3. Аксиомы биологии
- •14.3.1. Первая аксиома
- •14.3.2. Вторая аксиома
- •14.3.3. Третья аксиома
- •14.3.4. Четвертая аксиома
- •14.3.5. Физические представления аксиом биологии
- •14.4. Признаки живого и определения жизни
- •14.4.1. Совокупность признаков живого
- •14.4.2. Определения жизни
- •14.5. Физическая модель демографического развития СП. Капицы
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 15. ФИЗИЧЕСКИЕ И ИНФОРМАЦИОННЫЕ ПОЛЯ БИОЛОГИЧЕСКИХ СТРУКТУР
- •15.1. Физические поля и излучения функционирующего организма человека
- •Рис. 15.1. Схема физических полей в организме человека
- •15.1.1. Электромагнитные поля и излучения живого организма
- •Рис. 15.2. Распределение вокруг человека электрического поля, образующегося в результате биоэлектрической активности его сердца.
- •15.1.2. Тепловое и другие виды излучений
- •15.2. Механизм взаимодействия излучений человека с окружающей средой
- •15.2.1. Электромагнитное и ионизирующее излучения
- •15.2.2. Возможности медицинской диагностики и лечения на основе излучений из организма человека
- •15.3. Устройство памяти. Воспроизводство и передача информации в организме
- •15.3.1. Физические процессы передачи информационного сигнала в живом организме
- •Рис. 15.3. Строение нейрона.
- •Рис. 15.4. Электрический потенциал действия нервного импульса.
- •15.3.2. Физическая основа памяти
- •15.3.3. Человеческий мозг и компьютер
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 16ю ФИЗИЧЕСКИЕ АСПЕКТЫ БИОСФЕРЫ И ОСНОВЫ ЭКОЛОГИИ
- •16.1. Структурная организованность биосферы
- •16.1.1. Биоценозы
- •16.1.2. Геоценозы и биогеоценозы. Экосистемы
- •16.1.3. Понятие биосферы
- •16.1.4. Биологический круговорот веществ в природе
- •16.1.5. Роль энергии в эволюции
- •Рис. 16.1. Распределение солнечной энергии, поступающей на Землю.
- •16.2. Биогеохимические принципы В.И. Вернадского и живое вещество
- •16.2.1. Живое вещество
- •16.2.2. Биогеохимические принципы В.И. Вернадского
- •16.3. Физические представления эволюции биосферы и переход к ноосфере
- •16.3.1. Основные этапы эволюции биосферы
- •16.3.2. Ноосфера
- •16.3.3. Преобразование биосферы в ноосферу
- •16.4. Физические факторы влияния Космоса на земные процессы
- •Рис. 16.2. Общая схема солнечно-земных связей.
- •Рис. 16.3. Взаимодействие заряженных частиц от Солнца с магнитным полем Земли.
- •16.4.1. Связь Космоса с Землей по концепции А.Л. Чижевского
- •Александр Леонидович Чижевский
- •16.5. Физические основы экологии
- •16.5.1. Увеличение антропогенной нагрузки на окружающую среду
- •16.5.2. Физические принципы ухудшения экологии
- •16.6. Принципы устойчивого развития
- •16.6.1. Оценки устойчивости биосферы
- •16.6.2. Концепция устойчивого развития и необходимость экологического образования
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •Глава 17. ФИЗИЧЕСКИЕ МОДЕЛИ САМООРГАНИЗАЦИИ В ЭКОНОМИКЕ
- •17.1. Экономическая модель длинных волн Н. Д. Кондратьева
- •17.2. Обратимость и необратимость процессов в экономике
- •17.3. Синергетические представления устойчивости в экономике
- •17.4. Физическое моделирование рынка
- •17.5. Циклический характер экономических процессов в модели Н.Д. Кондратьева
- •17.6. Модель колебательных процессов в экономике
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА
- •ЛИТЕРАТУРА
- •Основная
- •Дополнительная
- •ТЕМЫ КУРСОВЫХ РАБОТ, РЕФЕРАТОВ И ДОКЛАДОВ
- •ВОПРОСЫ К ЗАЧЕТУ И ЭКЗАМЕНУ
- •СЛОВАРЬ ТЕРМИНОВ
- •ЛИТЕРАТУРА
- •СОДЕРЖАНИЕ
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
178 |
Миры, где пять материков, Искусства, знанья, воины, троны И память сорока веков!
Еще, быть может, каждый атом - Вселенная, где сто планет;
Taм все, что здесь, в· объме сжатом, Но также то,чего здесь нет.
Их меры малы, нo все та же Их бесконечность, как и здесь; Там скорбь и страсть, как здесь
и даже Там та же мировая спесь.
В. Брюсов.
Мир электрона
В этом параграфе приведены краткие сведения из химии, которые будут полезны для развития представлений о физике процессов в живой природе. Поскольку в основе жизнедеятельности любого живого организма лежат биохимические процессы, напомним физический смысл тех терминов и понятий, которые описывают химические процессы и реакции. Все материальные тела неживой природы состоят из атомов и молекул, что позволяет говорить об общности строения различных видов материи, в том числе молекул веществ, состоящих из одних и тех же химических элементов, атомов и элементарных частиц.
299
12.2.1. Химические понятия и определения
Под атомом понимают электронейтральную квантово-механическую частицу, состоящую из положительно заряженного ядра и отрицательно заряженных электронов, распределенных по оболочкам. Химический элемент — это совокупность определенных видов атомов с одинаковым зарядом ядра. В основе Периодической системы элементов Д.И. Менделеева лежит представление, что свойства химического элемента зависят от заряда атома, и это определяет место элемента в таблице.
В природе атомы в своем индивидуальном виде встречаются достаточно редко, для большинства химических элементов атомы обладают способностью отдавать или присоединять электроны, что обусловлено особенностью строения их электронных оболочек. Если атом имеет незаполненные внешние электронные оболочки, он нестабилен и легче вступает в химические реакции, отдавая или приобретая электроны на свою внешнюю оболочку в зависимости от валентности — способности атома к образованию химической связи. Поэтому реакционная способность элемента, его активность в химических реакциях определяется количеством электронов на внешних оболочках атома.
Вещество, которое состоит из атомов в определенном соотношении и объединенных определенной химической связью, является химическим соединением. Под химической связью понимается определенное взаимодействие атомов через их электроны и приводящее к заданной конфигурации атомов, по которой одни молекулы отличаются от других. Молекула — это наименьшая частичка вещества, обладающая его химическими свойствами. При образовании химических связей электроны переходят от одной молекулы к другой и уже не принадлежат какому-то отдельному атому, а обобщены (гибридизованы); при этом атомы теряют свою индивидуальность и свойства соединений отличаются от свойств составляющих их элементов.
Понятие «молекула» было введено французским химиком П. Гассенди (1592—1655) именно как «соединение атомов». Структура молекулы определяется пространственной и энергетической упорядоченностью квантово-механической системы, образованной электронами и атомными зарядами. Напомним, что поскольку электроны подчиняются законам квантовой механики, то при химических взаимодействиях надо представлять не определенные траектории электронов, соединяющих атомы и молекулы между собой, а некие «электронные облака»,
300
вероятность нахождения которых в пространстве определяется, как нам известно, квадратом модуля волновой функции |ψ|2.
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
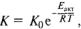
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
179 |
Химические реакции — это превращение одного или нескольких исходных веществ в отличающиеся от них по химическому составу и строению другие вещества. Химические реакции не меняют ни общего числа атомов, ни изотопного состава. Характеристиками химических реакций являются равновесная степень превращения, скорость реакции и глубина протекания. На языке физики все химические реакции — не что иное, как перестройка электронов в атомах электронов, участвующих в реакциях, в то время как ядра атомов в процессе этой реакции остаются незатронутыми.
Молекулы и атомы находятся в непрерывном тепловом движении, сталкиваясь друг с другом. Этот процесс происходит как самопроизвольно, так и под действием температуры, ионизирующих излучений, электрического тока, механических воздействий, катализаторов, и им можно управлять. При соударениях молекул выделяется достаточное количество энергии для разрыва связей, их перестройки, формирования нового набора атомов, изменения их числа, т.е. образования новых соединений. Это и есть физическое понимание химических реакций, которые могут быть обратимыми и необратимыми в зависимости от энергии реакции. Самопроизвольно реакция идет в сторону уменьшения энергии веществ и увеличения энтропии в ходе реакции. Обычно это отмечается стрелкой в химическом уравнении, направленной в сторону более низкой суммарной энергии связи в полном соответствии с принципами термодинамики: реакция идет, если в ходе ее свободная энергия системы уменьшается. Если реакция обратима, то стрелки направлены в обе стороны:
А + В AB.
AB.
Зная энтропии веществ, участвующих в реакции, можно определить условия, при которых возможно ее протекание. Если реакция сопровождается выделением тепла, ее называют экзотермической, если с поглощением, то — эндотермической. В зависимости от характера химической связи и энергии реакции наиболее зависимыми от условий протекания реакции являются соединения переменного состава, в которых связи между элементами ослаблены. На направление химических процессов влияет термодинамика, а скорость их протекания определяется кинетикой процесса. Физически же причина и ход всех химиче-
301
ских реакций объясняются двумя условиями: возрастанием энтропии в ходе самопроизвольной реакции и стремлением к уменьшению свободной энергии.
Представления о химических связях и реакциях тесно связаны с понятиями о
химической системе и химическом процессе. Химические системы могут быть равновесными и неравновесными. В равновесных системах идут обратимые химические реакции, а в неравновесных протекают необратимые процессы, как правило, цепные и разветвленные реакции. В этих реакциях возникают флуктуации, неустойчивости и развитие процессов подчиняется законам нелинейной динамики.
Химический процесс представляет собой последовательную смену состояний химической системы, в ходе которой образуется новое химическое вещество. Взаимодействие электронов и молекул приводит к изменению состава или структуры нового вещества. Важную роль здесь играет энергетика: стабильность соединения и возможность его перестройки и участия в химическом процессе будет зависеть от устойчивости электронных оболочек его атомов. Менее устойчивое соединение обладает большей свободной энергией, стабильное (упорядоченное, более организованное) — меньшей. Чтобы заставить вступить в реакцию разные соединения, надо сообщить устойчивому соединению дополнительную энергию, которую шведский химик С. Аррениус (1859—1927) назвал энергией активации Eaкт. Она определяет скорость протекания реакции К:
где R — молярная газовая постоянная, Τ — термодинамическая температура, K0 — скорость реакции при Τ = 0 К. Это выражение близко по форме и физическому смыслу распределению Л. Больцмана, хорошо описывающего хаотический характер взаимодействия участвующих в реакции частиц вещества.
Чтобы снизить порог начала реакции, обычно требуется уменьшить энергию активации, например путем катализа. Катализ — это процесс изменения скорости реакции под действием или при участии особых веществ — катализаторов, которые участвуют в реакции, но не входят в состав ее конечных продуктов. Катализаторы не сдвигают равновесий в химической системе: они ускоряют и прямую, и обратную реакции. Закономерности катализа были открыты русским химиком К. Кирхгофом
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
180 |
(1764—1833). Су-
302
ществуют также вещества, замедляющие процесс реакции, они называются ингибиторами. В биологии ингибиторами являются молекулы, которые, связываясь с биокатализаторами — ферментами, блокируют какую-то стадию ферментативной, т.е. ускоряющейся, реакции.
Внастоящее время технология получения до 80% различных химических веществ основана на каталитических процессах. Каталитическими являются и многие биохимические процессы в живой клетке, в которой роль катализаторов играют ферменты. Например, природным биокатализатором является хлорофилл, представляющий собой комплексное металлоорганическое соединение в живой ткани зеленых листов растений. Ферменты — белковые катализаторы — дают возможность быстро осуществлять химические реакции при низких температурах живого организма. Несмотря на то что ферменты обладают общими свойствами, присущими всем катализаторам, они отличаются от них тем, что функционируют в рамках живых систем. Катализаторы были известны давно, их широко использовали в древности, применяют и в настоящее время в виноделии, хлебопечении,. сыроварении, выделке кожи в других технологических химических процессах.
Роль катализатора может играть не только конкретное химическое вещество, но и сам химический процесс. Достаточно давно известны автокаталитические химические реакции, в которых конечный продукт ускоряет процесс, т.е. он сам становится катализатором. Они имеют большое значение для живых организмов, так как биохимические процессы в них носят преимущественно автокаталитический характер. Рассмотренная ранее реакция Белоусова—Жаботинского также является автокаталитической. Таким образом, понимание существа химических процессов и самих свойств соединений основано на представлениях о строении атомов и молекул, их квантово-механическом взаимодействии при химических превращениях.
Вхимических превращениях помимо атомов и молекул участвуют также кинетически независимые частицы, которые получили название свободных радикалов. Они имеют неспаренные электроны, их обозначают точкой сверху над символом элемента, например, Н. Они получаются из обычных молекул при отрыве от них отдельных атомов или даже групп атомов и содержат атомы элементов в ненасыщенном состоянии. Насыщаемость есть характеристика валентности связи, и она определяет
303
способность атомов вступать в химическую реакцию за счет оборванных химических связей, «свободных» мест для присоединения других электронов и образования новой связи. Этим объясняется сильная химическая активность свободных радикалов.
Радикалы участвуют в промежуточных стадиях реакции, и при этом энергия активации каждой последующей стадии реакции может понижаться. Если при этом промежуточные продукты реакции содержат ненасыщенные валентности, то это понижение особенно заметно. Примером реакции через промежуточные стадии служит образование хлористого водорода:
Первая ненасыщенная связь образуется при внешнем воздействии. Например, при поглощении света происходит расщепление молекулы хлора на два атома и отрыв электронов от молекулы. Затем реакция за счет появления свободных радикалов идет самопроизвольно, очень быстро и эффективно: один фотон способен образовать около 100 тысяч молекул хлористого водорода. Каждый раз согласно схеме приведенной реакции вместо ненасыщенной валентности одного атома (Н) возникает свободный
радикал другого (С1), и этот процесс идет поочередно.
Это так называемая цепная реакция, которая может происходить не только в виде рассмотренной выше фотохимической реакции. В работах известного российского ученого, Нобелевского лауреата по химии за 1956 г. H.H. Семенова (1896 — 1986) и его научной школы были развиты представления о разветвленных цепных реакциях, которые выходят за рамки чисто химических процессов. Эти реакции могут быть использованы в других моделях живой природы, социуме, технологиях (например, для описания реакций деления ядер урана) и лежат в основе ядерных технологий. На рис. 12.1 показано изменение свободной энергии при образовании химических связей в биоорганических молекулах живых организмов.
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
181 |
К особым видам химических соединений относятся также и макромолекулы. Они могут состоять из большого числа атомов, до нескольких тысяч, и обладают в отличие от обычной молекулы качественно новыми свойствами, как это имеет место в соотношении целого и его частей. Органическими молекулами являются те, которые содержат углерод, образованные из него веще-
304
ства также относят к органическим. Их насчитывается более 1700 тысяч. Одним из химических процессов органической химии является полимеризация — синтез макромолекул полимеров. Для образования каждой новой химической связи, а следова-
Рис. 12.1. Схема изменения свободной энергии и химической связи в молекулах живых организмов.
305
тельно, и полимера, требуется энергия (8—12 Дж/моль), так как все биологические
Горбачев В. В. Концепции современного естествознания:—М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2003. — 592 с: ил.
