
- •Содержание contents
- •Онкологические заболевания органов мочеполовой системы
- •1.1. Эпидемиология
- •1.2. Этиология, факторы риска
- •1.3. Профилактика
- •1.4. Скрининг
- •1.5. Топографическая и клиническая анатомия предстательной железы
- •1.6. Патоморфологическая характеристика рака предстательной железы
- •1.7. Экстрапростатическое распространение опухоли
- •1.8. Международная классификация рака предстательной железы по системе tnm
- •1.9. Диагностика рака предстательной железы
- •1.9.1. Методы диагностики отдаленных метастазов
- •1.9.2. Диагностика и степень распространенности опухолевого процесса
- •1.9.3. Клинические проявления ограниченного и местно распространенного рака предстательной железы
- •1.10. Клинические проявления диссеминированного рака предстательной железы
- •1.11. Оценка степени распространенности рака предстательной железы
- •1.12. Прогноз
- •1.13. Лечение рака предстательной железы
- •1.13.1. Выжидательная тактика
- •1.13.2. Радикальная простатэктомия
- •1.13.3. Неоадъювантная гормонотерапия
- •1.13.4. Адъювантная гормонотерапия
- •1.13.6. Альтернативные методы лечения локализованного рака предстательной железы
- •1.14. Контрольные вопросы
- •1.15. Тестовые задания
- •1.16. Рекомендуемая литература
- •2.1. Эпидемиология
- •2.2. Факторы риска
- •2.3. Патоморфологическая характеристика рака яичка
- •2.4. Клинические проявления
- •2.5. Диагностика рака яичка
- •Уровень хгт и альфа-фп в зависимости от нозологической формы опухоли яичка
- •2.6. Международная классификация рака предстательной железы по системе tnm
- •2.7. Лечение рака яичка
- •2.8. Контрольные вопросы
- •2.9. Тестовые задания
- •2.10. Рекомендуемая литература
- •3.1. Эпидемиология
- •3.2. Патоморфологическая характеристика рака яичка
- •3.3. Диагностика рака яичка
- •3.3.1. Рекомендации по диагностике рака полового члена
- •3.4. Международная классификация рака полового члена по системе tnm
- •3.5. Лечение рака полового члена
- •3.5.1. Первичная опухоль
- •3.5.2. Регионарные метастазы
- •3.5.3. Рекомендации по лечению рака полового члена
- •3.5.4. Качество жизни
- •3.5.5. Технические аспекты оперативного лечения рака полового члена
- •3.5.6. Химиотерапия
- •3.5.7. Прогностические факторы
- •3.6. Диспансеризация
- •3.6.1. Рекомендации по диспансеризации больных раком полового члена
- •3.7. Контрольные вопросы
- •3.8. Тестовые задания
- •3.9. Рекомендуемая литература
- •4.1. Эпидемиология
- •4.2. Этиология и патогенез
- •4.3. Патоморфологическая характеристика рака почки
- •4.4. Метастазирование рака почки
- •4.5. Спонтанная регрессия
- •4.6. Диагностика рака почки
- •4.7. Дифференциальная диагностика рака почки
- •4.8. Клинические проявления рака почки
- •4.9. Классификация рака почки
- •4.10. Прогноз
- •4.11. Хирургическое лечение рака почки
- •4.11.1. Хирургическое лечение локального рака почки
- •4.11.2. Выбор хирургического доступа
- •4.11.3. Хирургическое лечение местно распространенного рака почки
- •I. Опухолевое распространение на магистральные сосуды
- •II. Опухолевое распространение на соседние органы
- •III. Хирургическое лечение отдаленных метастазов
- •4.11.4. Паллиативные хирургические вмешательства
- •4.11.5. Осложнения при хирургическом лечении рака почки
- •4.11.6. Органосохраняющее лечение при раке почки
- •4.11.7. Эндоскопические операции
- •4.11.8. Хирургическое лечение солитарных и единичных метастазов рака почки
- •4.11.9. Хирургическое лечение местных рецидивов после нефрэктомии
- •4.12. Лекарственное лечение метастатического рака почки
- •4.13. Лучевая терапия
- •4.14. Контрольные вопросы
- •4.15. Тестовые задания
- •4.16. Рекомендуемая литература
- •5.7. Контрольные вопросы
- •5.8. Тестовые задания
- •5.9. Рекомендуемая литература
- •6.1. Эпидемиология
- •6.2. Факторы риска
- •6.3. Патоморфологическая характеристика
- •6.4. Классификация tnm
- •6.5. Клиническая картина
- •6.6. Диагностика опухолей мочевого пузыря
- •6.7. Лечение рака мочевого пузыря
- •6.7.1. Лечение поверхностного переходно-клеточного рака мочевого пузыря
- •6.7.2. Лечение инвазивного рака мочевого пузыря
- •6.7.3. Сравнительная оценка органосохраняющих и органоуносящих методов хирургического лечения рака мочевого пузыря
- •6.7.4. Вопросы пластики и протезирования мочевого пузыря
- •6.8. Лечение инвазивного рмп
- •6.9. Лучевая терапия
- •6.10. Генерализованный рак мочевого пузыря
- •6.11. Контрольные вопросы
- •6.12. Тестовые задания
- •6.13. Рекомендуемая литература
- •Первый вариант
- •Второй вариант
- •Глоссарий
- •Интернет ресурсы
- •Онкологические заболевания органов мочеполовой системы
- •644043 Г. Омск, ул. Ленина, 12; тел. 23-05-98
6.8. Лечение инвазивного рмп
Ведущее место в лечении инвазивного РМП принадлежит хирургическому методу. Наиболее распространенным типом оперативного вмешательства за рубежом является радикальная цистэктомия, выполняется во всех случаях, когда невозможно выполнение ТУР, за исключением опухоли верхушки мочевого пузыря. В России до сих пор широко применяется трансвезикальная резекция мочевого пузыря, исполняющаяся в различных вариантах. Однако к этой операции выработаны четкие показания. Считается, что она может быть произведена в следующих случаях:
1) опухоль должна быть одиночной, множественной при небольших размерах опухоли до 2-3см;
2) локализоваться на подвижных стенках мочевого пузыря и отстоять от шейки не менее чем на 1,5 см;
3) размеры опухоли не должны превышать 5–6 см в диаметре;
4) при инфильтрирующем росте опухоли, если размер не более 4-х см и она расположена задней, боковых стенок или верхушки;
5) в окружающей макроскопически не измененной слизистой оболочке и простатическом отделе уретры не должно быть рака in situ или тяжелых диспластических изменений.
При наличии значительного дефекта после резекции мочевого пузыря, встает вопрос о замещении дефекта. Наиболее часто используются методы пластик с формированием мочевого резервуара из различных отделов пищеварительной трубки, чаще кишечника.
1. Пластика петлей подвздошной кишки в виде замкнутой трубки: пластика продольно расположенной петлей, V- и J-образная пластика. При субтотальной резекции мочевого пузыря и нижней трети мочеточника Kucera один конец кишечного трансплантата фиксирует к оставшейся части мочевого пузыря, а другим замещает резецированную часть мочеточника (Рис.47).
2. Пластика распластанной петлей тонкой кишки в виде прямоугольника или
в виде перевернутой буквы „V“.
3. Пластика сегментом толстой кишки в виде замкнутой трубки. Gil Vernet использует илеоцекальный сегмент: сегментом толстой кишки замещает дефект мочевого пузыря, а отрезком подвздошной – мочеточник (Рис.48).

Показаниями к подобным операциям являются: - недостаточная емкость мочевого пузыря при спастическом и сморщенном (туберкулез, сморщивание мочевого пузыря) мочевом пузыре,- недостаточная емкость после резекции мочевого пузыря по поводу по поводу первичной опухоли или вторичной опухолевой инфильтрации.
Ведущее значение в лечении больных инвазивным раком мочевого пузыря имеет оперативное лечение. Стандартный хирургический подход к лечению этих больных является радикальная цистэктомия.
Радикальная цистэктомия
Показания к прведению:
Тотальное поражение опухолью слизистой мочевого пузыря;
Часто рецидивирующие опухоли, не чувствительные к внутрипузырной химиотерапии
Низкодифференцированные и недифференцированные опухоли при Т1.
У мужчин стандартный объем радикальной цистэктомии- удаление единым блоком мочевого пузыря с паравезикальной клетчаткой, предстательной железой, семенными пузырьками и билатеральная тазово-обтураторная лимфоаденэктомия. Важным вопросом после выполнения данной операции остается вариант отведения мочи. Необходимо выбрать такой способ отведения мочи, чтобы он обеспечивал больному высокий уровень качества жизни и наименьшее количество послеоперационных осложнений.
Отведение мочи после удаления мочевого пузыря.
Наружное отведение мочи (уретерокутанеостомия, формирование резервуара с наложением уростомы) наилучший метод отведения при выполнении цистэктомии у ослабленных больных, при запущенных стадиях заболевания, при выраженном уретерогидронефрозе и хронической почечной недостаточности.
Отведение мочи кишечник (уретероректосигмостомия)
Формирование ортотопического мочевого резервуара
Формирование гетеротопического резервуара
Формирование резервуара выполняют из различных отделов желудочно-кишечного тракта: подвздошной кишки, сигмовидной кишки др.
Кишечные методы отведения мочи:
Операция Бриккера (уретероилеокутанеостомия). Выполняется в 2 этапа. Выполняется радикальная цистэктомия. Затем выделяют сегмент подвздошной кишки длиной 15-20см, проксимальный конец сегмента зашивают. Дистальный выводят на кожу. Накладывают анатомозы между мочеточниками и прксимальной частью сегмента отступив от ушитого конца 3-4 см.
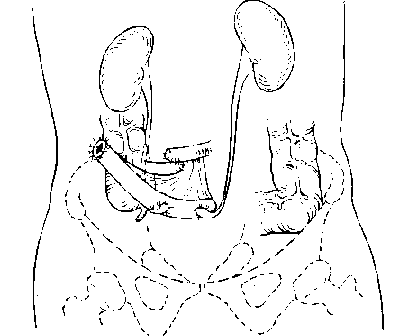
Д.Т. Гоцадзе и соавторы несколько модернизировали метод Brickera по созданию «сухой илеостомы». Резервуаром является слепая, восходящая и правая часть поперечно - ободочной кишки. Максимальный объем резервуара 600 - 800 мл. Антирефлюксную функцию илеоцекальной заслонки усиливают сужением терминальной части подвздошной кишки или инвагинацией, создавая клапан. Эвакуация мочи осуществляется самостоятельно пациентом путем катетеризации резервуара через стому, каждые через 4-6 часов.
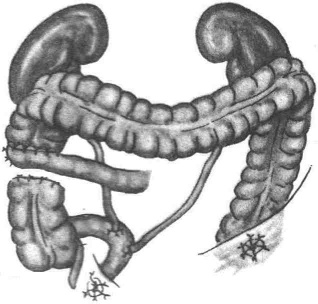
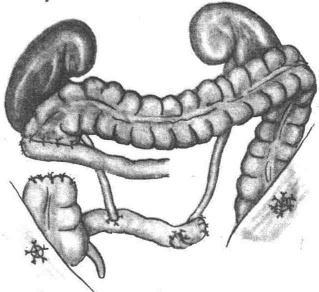
Операция Штудера (формирование ортотопического мочевого резервуара). Выполняют радикальную цистэктомиюВыделяют сегмент подвздошной кишки длиной 55-60см. Из детубулязированных дистальных 40см формируют сферический резервуар. Накладывают анастомозы между мочеточниками и нерассеченной приводящей частью сегмента. Формируют анастомоз с уретрой.
В 1969 году N. Kock сконструировал резервуар из 78 см. подвздошной кишки для кала у больного после колопроктэктомии (Рис.49). Техника заключается в рассечении антимезентериального края кишечного сегмента и сопоставлении сегментов кишки антиперистальтически, дальнейшем последовательном сшивании их, в результате чего образуется «мешочек». Пересечение циркулярных мышечных волокон позволяет сохранять в нем низкое давление. Это является принципиальным отличием резервуаров «высокого давления» для деривации мочи. В дальнейшем, сам автор усовершенствовал свою методику и на рисунке отображен один из последних ее вариантов. Метод был подвержен множеству модификаций, но основным недостатком по - прежнему являлось наличие мочевой стомы на передней брюшной стенке. Выбор илеоцекального угла был сделан в связи с его арефлюксным действием (клапан абсолютного барьерного действия по Я.Д. Витебскому). Созданный резервуар больные катетеризировали каждые 3-6 часов.
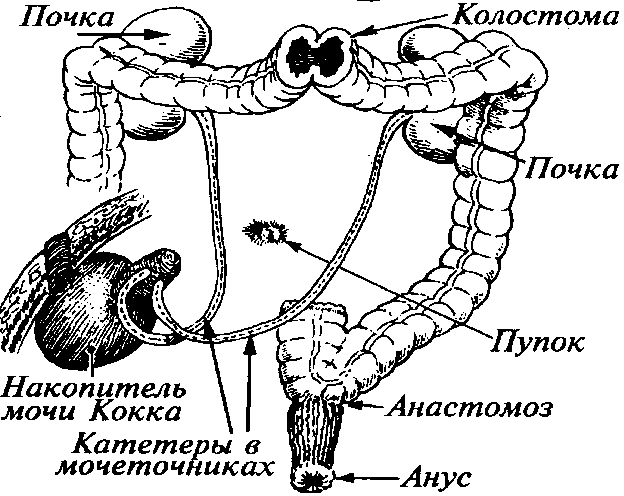
Рис.
49. Формирование
мочевого резервуара по методу Кокка.
Матвеев
П.Б., Фигурка К.М., Карякин О.Б. «Рак
мочевого пузыря» -Москва, 2001. -243с.
Послеоперационная летальность в крупных центрах составляет 2-5%. Интраоперационные осложнения - кровотечения, ранения прямой кишки.
Осложнения раннего послеоперационного периода:
-длительный парез кишечника
-кишечная непроходимость
-несостоятельность везикоуретрального анастомоза
-несостоятельность межкишечного анастомоза
-гнойно-септические осложнения
-острый пиелонефрит
Поздние послеоперационные осложнения
-эректильная дисфункция
-структура пузырно-уретрального анастомоза
-хронический пиелонефрит
-метаболические нарушения
Судя по опубликованным данным, результаты радикальной цистэктомии при инвазивном РМП следующие: до 60% больных страдают от рецидива заболевания; при этом локальные и локорегиональные рецидивы развиваются у 4,8–33% больных, а отдаленные метастазы появляются у 20–25%. Пятилетняя выживаемость зависит от стадии заболевания, составляя около 70% при опухолях, ограниченных стенкой мочевого пузыря, и снижаясь до 20–25% при распространении опухоли на паравезикальную клетчатку или смежные органы. Прогноз еще более ухудшается при метастатическом поражении регионарных лимфатических узлов – лишь единичные больные переживают 5 лет.
Широкое применение при инвазивном и диссеминированном РМП нашла системная химиотерапия. Ее можно проводить в нескольких вариантах: как неоадъювантную химиотерапию при местно распространенной опухоли, как адъювантное лечение у больных с высоким риском рецидива и как самостоятельный метод при диссеминированных поражениях.
Задачами неоадъювантной химиотерапии являются:
1) уменьшение размеров или стадии новообразования;
2) повышение абластичности операции и увеличение резектабельности опухоли;
3) воздействие на микрометастазы.
К достоинствам неоадъювантной химиотерапии следует отнести возможность определения чувствительности опухоли к химиопрепаратам in vivo, раннее начало лечения микрометастазов, возможность сохранения мочевого пузыря при полной регрессии опухоли. Недостатки неоадъювантной химиотерапии: не все больные нуждаются в лечении по поводу микрометастазов; токсичность; если химиотерапия неэффективна, упускается время для выполнения радикальной операции.
Результаты неоадъювантной химиотерапии противоречивы. Некоторые авторы считают, что она улучшает отдаленные результаты на 10–15%, другие полагают, что неоадъювантная химиотерапия улучшает результаты лечения лишь больных с поздними стадиями заболевания (Т3–Т4); третьи не видят преимуществ по сравнению с одной цистэктомией; наконец, существует мнение, что результаты неоадъювантной химиотерапии лишь выделяют больных с хорошим (полная регрессия опухоли) и плохим (частичная регрессия и без эффекта) прогнозом.
Показаниями к адъювантной химиотерапии являются следующие:
1) наличие метастазов в удаленных лимфатических узлах,
2) опухолевая инфильтрация паравезикальной клетчатки,
3) инвазия опухоли в лимфатические или кровеносные сосуды.
Достоинством адъювантной химиотерапии является воздействие на малый объем опухоли (микрометастазы), что создает благоприятные условия для достижения положительного результата, и то, что не теряется время до цистэктомии. Недостатки: отсутствует контроль за эффективностью лечения – часть больных получают заведомо неэффективную терапию.
Результаты адъювантной химиотерапии также противоречивы. Ряд исследователей считают, что она не влияет на результаты цистэктомии, другие полагают, что улучшаются на 20–30% отдаленные результаты лечения лишь в группе с высоким риском рецидива, третьи видят положительное влияние адъювантной химиотерапии в увеличении продолжительности безрецидивного периода.
Наиболее эффективными комбинациями химиопрепаратов до недавнего времени являлись M-VAC (цисплатин, метотрексат, винбластин и доксорубицин) и CMV (цисплатин, метотрексат, винбластин). Объективный эффект достигался у 50–60% больных. Средняя продолжительность жизни больных с диссеминированной опухолью составляла около 1 года, менее 5% переживали 5 лет.
Применение схем химиотерапии, в основе которых лежит использование цисплатина и метотрексата, связано с сущеcтвенной токсичностью. Токсические проявления заключаются в развитии нейтропении и инфекционных осложнений на ее фоне, выраженных мукозитов, вызывающих трудности в приеме пищи, диарреи, которые ухудшают общее состояние больного, приводят к потере массы тела, слабости. Кроме того наблюдаются тошнота и рвота, почечная, кардиальная и неврологическая токсичность.
Новые режимы и схемы лечения стали изучаться в связи с появлением новых химиопрепаратов. Одним из наиболее перспективных является гемзар (гемцитабин) – противоопухолевый агент из группы антиметаболитов, который показал высокую активность у больных переходно клеточным раком мочевого пузыря. Лечение по схеме гемзар + цисплатин оказалось достаточно безопасное и столь же эффективным, как и режим MVAC. Комбинацию GC можно использовать при местно распространенном и диссеминированном переходно-клеточном РМП в качестве стандартного лечения.
