
- •Научные консультанты:
- •Сокращения и глоссарий
- •Введение
- •Обзор литературы
- •1.1 Торможение в гиппокампе
- •1.1.1 ГамКергическая синаптическая передача
- •1.1.2 ГамКергические рецепторы
- •1.1.3 Разнообразие форм торможения
- •1.1.4 Механизмы и функциональное значение тонического торможения
- •1.2 Взаимодействие между глутамат и гамКергической системами
- •1.2.1 Гетеросинаптические взаимодействия
- •1.2.2 Критерии гетеросинаптической депрессии
- •1.2.3 Метаботропные рецепторы группы III в гиппокампе
- •1.2.4 Каинатные рецепторы в гиппокампе
- •1.3 Механизмы фокального эпилептогенеза
- •1.3.1 Исследования эпилептогенеза
- •1.3.2 Критерии развития эпилептиформной активности
- •1.3.3 Возбуждающие механизмы в эпилептогенезе
- •1.3.4 Тормозные механизмы в эпилептогенезе
- •1.4 Постановка цели и задач исследования
- •2. Материалы и методы
- •2.1 Срезы гиппокампа
- •2.1.1 Приготовление и растворы
- •2.1.2 Рабочая установка для поддержания срезов и манипуляторы
- •2.1.3 Идентификация клеток с помощью световой микроскопии
- •2.2 Регистрация и анализ полевых потенциалов
- •2.3 Записи и анализ токов (потенциалов) в режиме фиксации потенциала (тока) с одиночных нейронов
- •2.3.1 Электроды и внутриклеточные растворы
- •2.3.2 Проведение регистраций и сохранение данных
- •2.3.2 Анализ спонтанных и вызванных ответов в режиме фиксации потенциала
- •2.4 Записи и анализ ответов на ионтофоретические аппликации
- •2.5 Записи и анализ токов с outside-out patch
- •2.5.1 Приготовление outside-out patch
- •2.5.2 Система быстрой аппликации веществ
- •2.5.3 Определение биофизических свойств рецепторов с использованием анализа токов, полученных с outside-out пейчей
- •2.6 Модели эпилептогенеза in vivo
- •2.6.1 Электрический киндлинг
- •2.6.2 Модель аудиогенной судорожной активности. Аудиогенный киндлинг
- •2.7 Использованные вещества
- •2.8 Статистический анализ
- •3 Результаты исследованИй и их обсуждение
- •3.1 Нетипичные фармакологические свойства гамКергических рецепторов в гиппокампальных интернейронах
- •3.1.1 Различная чувствительность ионотропных гамКергических рецепторов к пикротоксину в интернейронах и пирамидных клетках
- •3.1.2 Ионные каналы ионотропных гамКергических рецепторов в интернейронах и пирамидных клетках имеют различную проводимость
- •3.1.3 Ионотропные гамКергические рецепторы как в интернейронах, так и пирамидных клетках чувствительны к агонисту гамкс рецепторов
- •3.1.4 Пентобарбитал по-разному модулирует гамКергические токи, вызываемые аппликацией caca (50 м)
- •3.1.5 Тпст в интернейронах, регистрируемые в присутствии 100 м пикротоксина, обладают повышенной чувствительностью к антагонисту гамкс рецепторов
- •3.1.6 Токи, опосредованные гамКергическими рецепторами, в присутствии 100 м пикротоксина возникают за счет характерной Cl-/hco3- ионой проводимости
- •3.1.7 Эффект аллостерических модуляторов гамка рецепторов на устойчивые к пикротоксину токи, опосредованные гамКергическими рецепторами
- •3.1.8 Сравнение эффективности антагонистов гамка и гамкс рецепторов на устойчивые к пикротоксину токи, опосредованные гамКергическими рецепторами
- •3.1.9 Интернейроны содержат рецепторы, обладающие нетипичными фармакологическими свойствами
- •3.1.10 Нетипичные гамКергические рецепторы и традиционные типы рецепторов (гамка и гамкс)
- •3.1.11 Возможная субъединичная композиция нетипичных гамКергических рецепторов в интернейронах
- •Заключение
- •3.2 Регуляция возбудимости нейронов гиппокампа за счет гамКергического тонического торможения
- •3.2.1 Базовый тонический гамКергический ток специфичен для интернейронов, но не пирамидных клеток
- •3.2.2 Увеличение внеклеточной концентрации гамк ведет к возникновению тонического тока в пирамидных клетках и повышению в интернейронах
- •3.2.3 Температурная зависимость тонического гамКергического тока и фазических спонтанных тпст
- •3.2.4 Возможная роль тонического торможения в эпилептогенезе
- •3.2.5 Заключение
- •3.3 Модуляция гамКергической передачи в гиппокампе метаботропными рецепторами
- •3.3.1 L-ap4 подавляет и тормозные, и возбуждающие синаптические токи в интернейронах
- •Демонстрирующих отсутствие метаботропных рецепторов группы III на терминалях коллатералей Шаффера, оканчивающихся на пирамидных клетках са1.
- •3.3.2 Синаптически высвобождаемый глутамат снижает тпст
- •3.3.3 Глутамат опосредует гетеросинаптическую депрессию тпст
- •3.3.4 Изменения в эффективности обратного захвата глутамата влияет на гетеросинаптическую депрессию
- •3.3.5 Метаботропные рецепторы группы III опосредуют гетеросинаптическую депрессию по двум различным механизмам
- •3.3.6 Метаботропные рецепторы группы III модулируют частоту спонтанных тпст
- •3.3.7 Возможные молекулярные механизмы депрессии тпст при активации mGluR группы III
- •3.3.8 Последствия активации mGluR группы III для общей возбудимости нейрональной сети поля са1
- •3.3.9 Гетеросинаптическая депрессия, опосредованная метаботропными гамкb рецепторами
- •3.3.10 Заключение
- •3.4 Каинатные рецепторы модулируют гамКергическое торможение в гиппокампальных интернейронах
- •3.4.1 Каинат увеличивает частоту и амплитуду спонтанных тпст в интернейронах
- •3.4.2 Каинат увеличивает вероятность генерации антидромных потенциалов действия в интернейронах
- •3.4.3 Каинат вызывает спонтанные аксональные потенциалы действия
- •3.4.4 Спилловер глутамата активирует аксональные каинатные рецепторы
- •3.4.5 Последствия аксональной деполяризации, вызываемой каинатными рецепторами, для гамКергической передачи
- •3.4.6 Каинат усиливает вызванные тпст в интернейронах
- •3.4.7 Каинат приводит к увеличению гамКергического тонического тока
- •3.4.8 Последствия усиления гамКергической передачи в интернейронах, вызываемой каинатными рецепторами, для возбудимости нейрональной сети
- •3.4.9 Заключение
- •3.5 Оказывают ли метаботропные рецепторы группы III и каинатные рецепторы противоположное действие на гамКергическую передачу?
- •3.6 Механизмы развития пачечной активности в гиппокампе
- •3.6.1 Кратковременные увеличения внеклеточной концентрации калия создают долговременное снижение порога развития пачечных разрядов в поле са1 гиппокампа
- •3.6.2 Развитие пачечных разрядов в поле са1 гиппокампа не зависит от активности нейронов поля са3
- •3.6.3 Окклюзия развития пачечных разрядов в поле са1 в ответ на кратковременные увеличения внеклеточной концентрации калия в моделях эпилептогенеза in vivo
- •3.6.4 Является ли пачечная активность в поле са1 гиппокампа эпилептиформной?
- •3.6.5 Способность пирамидных нейронов поля са1 генерировать пачечные разряды сопровождается повышением возбудимости этих клеток
- •3.6.6 Роль nmda рецепторов и l-типа кальциевых каналов в повышение возбудимости пирамидных клеток и генерации пачечных разрядов
- •3.6.7 Заключение
- •Заключение
- •Клеткоспецифичность гамКергического торможения в гиппокампе
- •Клеткоспецифичность модуляции гамКергического торможения в гиппокампе
- •Возбудимость и торможение в эпилептогенезе
- •Эффектов веществ влияющих на гамКергические механизмы, описанные в данной диссертационной работе, представлена втаблице 4.1 (см также Рис. 4.1). Выводы
- •Список рисунков
- •Список литературы
3.1.3 Ионотропные гамКергические рецепторы как в интернейронах, так и пирамидных клетках чувствительны к агонисту гамкс рецепторов
Известно, что чувствительность к пикротоксину ГАМКергических рецепторов определяется наличием боковых цепочек аминокислот в сегменте M2, покрывающих внутреннюю часть канала, в частности, треонина разных субъединиц, находящегося в R6положении (Xu and Akabas 1996; Zhang et al. 1995a; Zhang et al. 1995b; Zhorov and Bregestovski 2000). Среди субъединиц ГАМКергических рецепторов грызунов только ρ2имеют отличную аминокислоту в этом участке, что делает гомомерные и гетеромерные ρ2-содержащие рецепторы относительно нечувствительными к пикротоксину (Greka et al. 1998; Zhang et al. 1995a). При этом, близкородственная ρ1субъединица содержит треонин в R6положении и гомомерные рецепторы чувствительны к пикротоксину (Zhang et al. 2001). Возможно, в нашем исследовании сниженная чувствительность к пикротоксину связана с наличием в интернейрональном ГАМКергическом токе компонента, связанного с рецепторами содержащими ρ2субъединицу. В таком случае, пикротоксин нечувствительные токи должны фармакологически отличаться от пикротоксин чувствительных. Это связано с тем, что ρ-содержащие рецепторы (ГАМКС) имеют ряд отличий по отношению к агонистам, антагонистам и аллостерическим модуляторам классических ГАМКАрецепторов. Показано, что ГАМКСрецепторы принимают участие в ГАМКергической передаче в ретине, спинном мозге и superior colliculus (Bormann 2000b; Zhang et al. 2001). Известно, что нативные ГАМКCрецепторы в ретине также обладают сниженной чувствительностью к пикротоксину и низкой проводимостью одиночных каналов в сравнении с ГАМКАрецепторами (Feigenspan et al. 1993). Однако, до настоящего времени не было показано роли ГАМКСрецепторов в гиппокампе, не смотря на иммуноцитохимические данные, указывающие на наличие в нем РНК, кодирубщей ρ-субъединицы (Enz et al. 1995; Enz and Cutting 1999; Ogurusu et al. 1999; Wegelius et al. 1998).
В последнее время стали появляться доказательства того, что, по крайней мере, рекомбинантные ρ-субъединицы могут образовывать функциональные ГАМКергические рецепторы с γ2субъединицами (Pan et al. 2000; Qian and Ripps 1999). Эти данные указывают на теоретическую возможность определенных отклонений ГАМКергических токов в гиппокампе от фармакологического профиля токов, опосредованных классическими ГАМКАрецепторами. Иммуноцитохимические исследования также показали, что плотность γ2субъединиц намного выше в интернейронах поля CA1, чем в пирамидных клетках (Sperk et al. 1997). Вместе взятые, эти данные указывают на то, что низкая чувствительность к пикротоксину в интернейронах, может объясняться комбинацией субъединиц ГАМКергических рецепторов, отличной от комбинации в классических ГАМКАрецепторах.
Приняв во внимание сходство параметров ГАМКергических рецепторов интернейронов и ГАМКСрецепторов (низкая чувствительность к пикротоксину и низкая проводимость одиночного канала), мы решили проверить на них эффект фармакологических агентов, специфичных для ГАМКСрецепторов. Мы провели
ПК
Рис. 3.1.3 Генерализованная аппликация САСА (50 µМ) вызывает большие по амплитуде токи в пирамидных клетках, чем в интернейронах
а, Аппликация CACA (50 µМ), специфического
агониста ГАМКСрецепторов,
производит увеличение тока компенсации
в режиме фиксации потенциала как в
интернейронах ( ),
так и в пирамидных клетках (
),
так и в пирамидных клетках ( ).
Причем величина этого тока значительно
выше в пирамидных клетках (ПК) - 153 ± 26 пА
(n=5), чем в интернейронах (ИН) 55 ± 13 пА
(n=4), p=0,02, t-тест (б).
).
Причем величина этого тока значительно
выше в пирамидных клетках (ПК) - 153 ± 26 пА
(n=5), чем в интернейронах (ИН) 55 ± 13 пА
(n=4), p=0,02, t-тест (б).

аппликацию специфического агониста ГАМКСрецепторов, цис‑аминокротоновой кислоты (CACA). Это вещество активирует рекомбинантные ГАМКСрецепторы с Kd= 74 μМ и приблизительно в 130 раз менее эффективно для активации ГАМКАрецепторов (Kusama et al. 1993). Необычным оказалось то, что аппликация низкой концентрации CACA (50 μМ, без пикротоксина) приводила к возникновению значительных по амплитуде токов как в интернейронах, так и пирамидных клетках (Рис. 3.1.3а). Неожиданным оказалось то, что величина тока была даже выше в пирамидных клетках, чем в интернейронах (55 ± 13 пА; n=4 в интернейронах; 153 ± 26 пА; n=5 в пирамидных клетках; p=0,02 t-тест между двумя типами клеток; Рис. 3.1.3б). Эти результаты указывают на наличие ГАМКC-подобных рецепторов в обоих типах клеток и даже на более высокое их содержание в пирамидных нейронах. Однако, мы не стали сразу делать заключение о том, что полученный ток вызван ГАМКСрецепторами. Существует предположение, что CACA может содержать небольшие количества (до 0,1 %) своего трансэнантиомера ТАСА (транс-аминокротоновой кислоты) – рацемическая смесь (Johnston 1996). TACA – более мощный агонист ГАМКАрецепторов, чем CACA (Kusama et al. 1993). Возможно, что ток, который возникает при аппликации CACA, на самом деле, происходит от активации ГАМКАрецепторов, опосредованной примесью ТАСА. Чтобы проверить это, мы апплицировали различные концентрации TACA. Низкая концентрация ТАСА (50 нМ), соответствующая ее содержанию 0,1 % в CACA (50 µМ) не вызвала никакого тока. Нам удалось получить сравнительно небольшой ток (2415 % от тока вызываемого аппликацией 50М CACA; n=5; p=0,03; Рис. 3.1.4а) только при концентрации TACA 2,5М, что соответствует 5 % от использованной концентрации CACA. Даже при аппликации TACA в концентрации 15М (33,3 % от САСА) нам не удалось получить тока, достигающего по величине ток, полученный при аппликации CACA (7211 % от CACA тока; n=5; p=0,03).
Таким образом, CACA вызывает значительный по величине ток в концентрации <1 % от Kdдля ГАМКАрецепторов (9.7 мМ) (Kusama et al. 1993) и этот эффект не связан с содержанием в этом веществе TACA, более мощного агониста ГАМКАрецепторов.
Другое возможное объяснение возникновения тока при аппликации CACA может быть связано с ее непрямым действием на ГАМКАрецепторы. Было показано, что CACA вызывает высвобождение H3-ГАМК в срезах мозга при концентрации приблизительно в 10 выше, чем EC50для ГАМКСрецепторов (Chebib and Johnston 1997). Этот эффект был связан с ее влиянием на GAT3 (транспортер ГАМК) и исчезал при аппликации 100М‑аланина, блокатора данного транспортера.
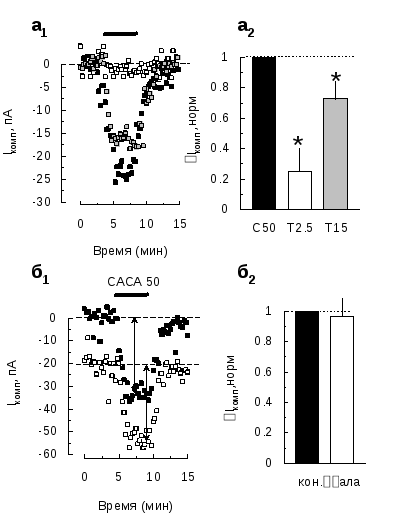
Рис. 3.1.4 Ток, вызываемый аппликацией CACA, связан с прямой активацией ионотропных ГАМКергических рецепторов
а, Аппликации TACA 2,5 µМ ( )
и 15 µM (
)
и 15 µM ( )
производили меньшие по амплитуде токи,
чем CACA 50 µМ (
)
производили меньшие по амплитуде токи,
чем CACA 50 µМ ( ).а1, Эффект аппликаций ТАСА
и САСА на ток компенсации. Данные,
полученные с одного нейрона. Ток
компенсации до аппликации агонистов
был приравнен к нулю (пунктирная линия)a2, Данные, усредненные по
нескольким клеткам. Ток, полученный при
аппликации 2,5 µМ (Т2.5; 5% от концентрации
CACA) составлял 24 ± 15 % (n=5), при
аппликации 15 µМ (Т15; 33% от концентрации
CACA) – 72 ± 11 % (n=5) от тока вызываемого
CACA 50 µМ (С50). Эти данные выступают
против гипотезы, что ток вызываемый
аппликацией CACA (селективного агониста
ГАМКСрецепторов) связан с
содержанием в веществе небольших
концентраций (<0,1 %) стереоэнантиомера
TACA, более эффективного агониста ГАМКАрецепторов.б, Аппликация CACA 50 µМ
в присутствии β-аланина 100 µМ (блокатора
GAT3 – транспортера ГАМК) вызывала ток
(
).а1, Эффект аппликаций ТАСА
и САСА на ток компенсации. Данные,
полученные с одного нейрона. Ток
компенсации до аппликации агонистов
был приравнен к нулю (пунктирная линия)a2, Данные, усредненные по
нескольким клеткам. Ток, полученный при
аппликации 2,5 µМ (Т2.5; 5% от концентрации
CACA) составлял 24 ± 15 % (n=5), при
аппликации 15 µМ (Т15; 33% от концентрации
CACA) – 72 ± 11 % (n=5) от тока вызываемого
CACA 50 µМ (С50). Эти данные выступают
против гипотезы, что ток вызываемый
аппликацией CACA (селективного агониста
ГАМКСрецепторов) связан с
содержанием в веществе небольших
концентраций (<0,1 %) стереоэнантиомера
TACA, более эффективного агониста ГАМКАрецепторов.б, Аппликация CACA 50 µМ
в присутствии β-аланина 100 µМ (блокатора
GAT3 – транспортера ГАМК) вызывала ток
( ),
который не значительно отличался от
CACA-тока при базовых условиях (
),
который не значительно отличался от
CACA-тока при базовых условиях ( ).б1, Эффект аппликаций на
ток компенсации. Данные, полученные с
одного нейрона. Ток компенсации до
добавления β-аланина был приравнен к
нулю (верхняя пунктирная линия). β-аланин
сам по себе увеличивал ток компенсации
(нижняя пунктирная линия).б2,
Усредненный по нескольким клеткам (n=5)
СACA-опосредованный ток, полученный в
присутствии 100 µМ β-аланина (β-ала)
составил 98 ± 11 % от тока вызываемого
CACA при базовых условиях (кон.). Эти
данные выступают против гипотезы, что
ток вызываемый аппликацией CACA связан
с гетерообменом CACA/ГАМК при участии
ГАМК транспортера GAT3.
).б1, Эффект аппликаций на
ток компенсации. Данные, полученные с
одного нейрона. Ток компенсации до
добавления β-аланина был приравнен к
нулю (верхняя пунктирная линия). β-аланин
сам по себе увеличивал ток компенсации
(нижняя пунктирная линия).б2,
Усредненный по нескольким клеткам (n=5)
СACA-опосредованный ток, полученный в
присутствии 100 µМ β-аланина (β-ала)
составил 98 ± 11 % от тока вызываемого
CACA при базовых условиях (кон.). Эти
данные выступают против гипотезы, что
ток вызываемый аппликацией CACA связан
с гетерообменом CACA/ГАМК при участии
ГАМК транспортера GAT3.
Чтобы исключить непрямое действие САСА через ГАМК транспортер, мы провели ее аппликацию в присутствии 100 М‑аланина.‑аланин сам по себе приводил к возникновению входящего тока (Рис. 3.1.4б). Возникновение этого тока может объясняться как блокадой обратного захвата (uptake) ГАМК, так и прямым агонистическим действием‑аланина на глициновые рецепторы. В этих условиях аппликация CACA (50М) также приводила к возникновению тока, незначительно отличающегося от тока без‑аланина (9811 % - ток в присутствии‑аланина от тока без него; n=5; p=0,8). Таким образом, аппликация CACA активировала ГАМКергические рецепторы прямо, а не через накопление ГАМК, влияя на транспортер GAT3. Этот результат указывает на наличие как в интернейронах, так и пирамидных клетках поля СА1 гиппокампа тока, чувствительного к агонистам ГАМКСрецепторов.
Таким образом, нами впервые была продемонстрирована фармакологическая активность агониста ГАМКСрецепторов в гиппокампе. Однако, в этих экспериментах нам не удалось объяснить различную чувствительность интернейронов и пирамидных клеток к пикротоксину. Для ответа на этот вопрос, мы решили проверить, каким образом ГАМКергические токи в интернейронах и пирамидных клетках будут модулироваться аллостерическими модуляторами ГАМКАрецепторов.
