
- •Кафедра физики
- •Требования к оформлению и общие методические указания
- •1. Кинематика поступательного и вращательного движения
- •Криволинейное движение
- •Примеры решения задач
- •2. Динамика материальной точки
- •Примеры решения задач
- •3. Законы сохранения
- •Примеры решения задач
- •Решение
- •4. Молекулярно-кинетическая теория
- •Примеры решения задач
- •5. Основы термодинамики
- •Примеры решения задач
- •Решение
- •6. Электростатика
- •Примеры решения задач
- •Решение
- •Решение
- •7. Законы постоянного тока
- •Примеры решения задач
- •8. Электромагнетизм
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Варианты задач Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 9
- •Вариант 10
- •4. Найдите кпд тепловой машины, работающей по циклу 1–2–3–1 (рис.4). Рабочее тело – одноатомный идеальный газ.
- •Вариант 11
- •3. 10 Моль одноатомного идеального газа сначала охладили, уменьшив давление в 3 раза, а затем нагрели до первоначальной температуры 300 к (рис.2). Какое количество теплоты получил газ на участке 2–3?
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Вариант 31
- •Вариант 32
- •Вариант 33
- •Вариант 34
- •Вариант 35
- •Вариант 36
- •Вариант 37
- •Вариант 38
- •Вариант 39
- •Вариант 40
- •Вариант 41
- •Вариант 42
- •Вариант 43
- •Вариант 44
- •Вариант 45
- •Вариант 46
- •Вариант 47
- •Вариант 48
- •Вариант 49
- •Вариант 50
- •Вариант 51
- •Вариант 52
- •Вариант 53
- •Вариант 54
- •Вариант 55
- •Вариант 56
- •Вариант 57
- •Вариант 58
- •Вариант 59
- •Вариант 60
- •Вариант 61
- •Вариант 62
- •Вариант 63
- •Вариант 64
- •Вариант 65
- •Вариант 66
- •Вариант 67
- •Вариант 68
- •Вариант 69
- •Вариант 70
- •Вариант 71
- •Вариант 72
- •Вариант 73
- •Вариант 74
- •Вариант 75
- •Вариант 76
- •Вариант 77
- •Вариант 78
- •Вариант 79
- •Вариант 80
- •Вариант 81
- •Вариант 82
- •Вариант 83
- •Вариант 84
- •Вариант 85
- •Вариант 86
- •Вариант 87
- •Вариант 88
- •Вариант 89
- •Вариант 90
- •Библиографический список
- •Содержание
Решение
По закону сохранения импульса (рис.3.1):
![]() .
.
В проекциях на координатные оси:
O X:
X:
![]() (1)
(1)
OY:
![]() (2)
(2)
Из (2) следует:
![]() ,
(3)
,
(3)
тогда (1) можно записать:
![]() (4)
(4)
Удар абсолютно упругий, поэтому сохраняется полная механическая энергия:
![]() (5)
(5)
Решая уравнение
(5) совместно с (3), найдём скорости υ1
и υ2:
![]() ;
;

![]()
![]()
![]()
![]() ;
;
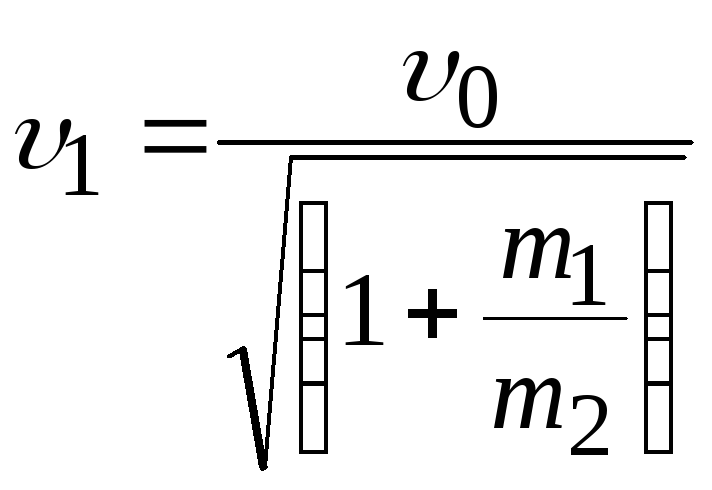 .
.
Расчёты:
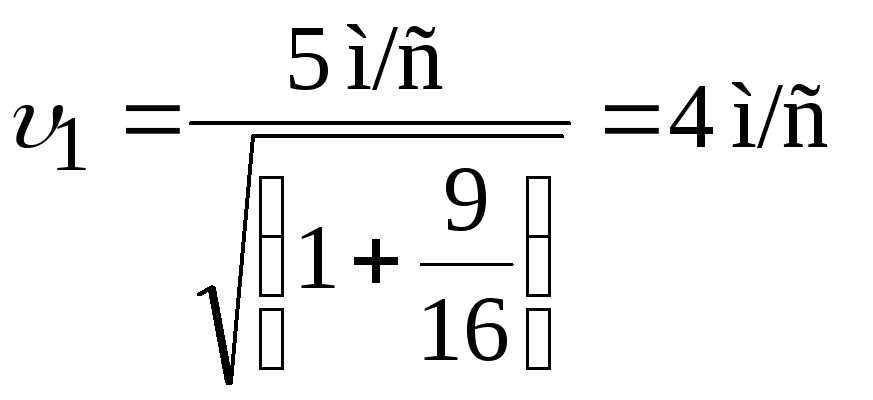 ;
;
![]() .
.
Из (4) выразим cosα:
![]() ;
;
![]() .
.
Тогда β=2α=1020.
Ответ: υ1=4 м/с; υ2=2.25 м/с; β=1020.
4. Молекулярно-кинетическая теория
Краткая теория
![]() Относительная
молекулярная (атомная)
масса
– отношение массы молекулы (атома)
Относительная
молекулярная (атомная)
масса
– отношение массы молекулы (атома)
![]() данного вещества к
данного вещества к![]() массы атома углерода
массы атома углерода![]() (изотопа12С):
(изотопа12С):
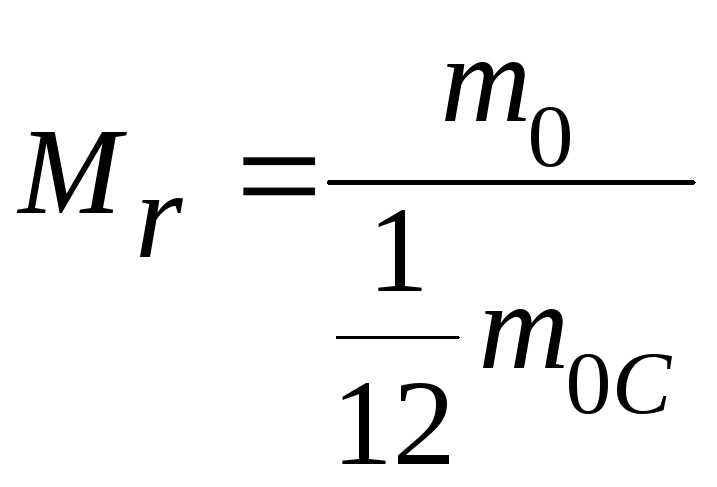 .
.
![]() Моль
–
количество вещества, в котором содержится
столько же молекул или атомов, сколько
атомов содержится в 0.012 кг углерода 12С.
Моль
–
количество вещества, в котором содержится
столько же молекул или атомов, сколько
атомов содержится в 0.012 кг углерода 12С.
![]() В
одном моле любого вещества содержится
одно и то же число молекул или атомов,
которое
называется числом (постоянной) Авогадро.
Число Авогадро равно
В
одном моле любого вещества содержится
одно и то же число молекул или атомов,
которое
называется числом (постоянной) Авогадро.
Число Авогадро равно
![]()
![]() Количество
вещества
ν
– число молей, равное отношению числа
молекул N
к числу Авогадро:
Количество
вещества
ν
– число молей, равное отношению числа
молекул N
к числу Авогадро:
![]() .
.
![]() Молярная
масса
µ
– масса одного моля вещества:
Молярная
масса
µ
– масса одного моля вещества:
![]() ,
,
где
![]() – масса одной молекулы;
– масса одной молекулы;![]() – число Авогадро. Поскольку масса
вещества – это произведение массы одной
молекулы на их количество:
– число Авогадро. Поскольку масса
вещества – это произведение массы одной
молекулы на их количество:
![]() ,
то количество вещества равно:
,
то количество вещества равно:
![]() .
.
![]() Относительная
молекулярная масса вещества:
Относительная
молекулярная масса вещества:
![]() ,
,
где
ni
–
число атомов i-го
химического элемента, входящего в состав
молекулы данного вещества; ![]() –
относительная атомная масса этого
элемента. Относительные атомные массы
приводятся в таблице Д. И. Менделеева.
–
относительная атомная масса этого
элемента. Относительные атомные массы
приводятся в таблице Д. И. Менделеева.
![]() Связь
молярной массы с относительной
молекулярной массой:
Связь
молярной массы с относительной
молекулярной массой:
![]() .
.
![]() Давление,
производимое газом на стенки сосуда:
Давление,
производимое газом на стенки сосуда:
![]() ,
,
где
n
– концентрация молекул;
![]() – масса одной молекулы;
– масса одной молекулы;![]() – средняя квадратичная скорость молекул.
– средняя квадратичная скорость молекул.
![]() Концентрация
молекул – число молекул в единице
объёма:
Концентрация
молекул – число молекул в единице
объёма:
![]() .
.
![]() Средняя
квадратичная скорость (по определению):
Средняя
квадратичная скорость (по определению):
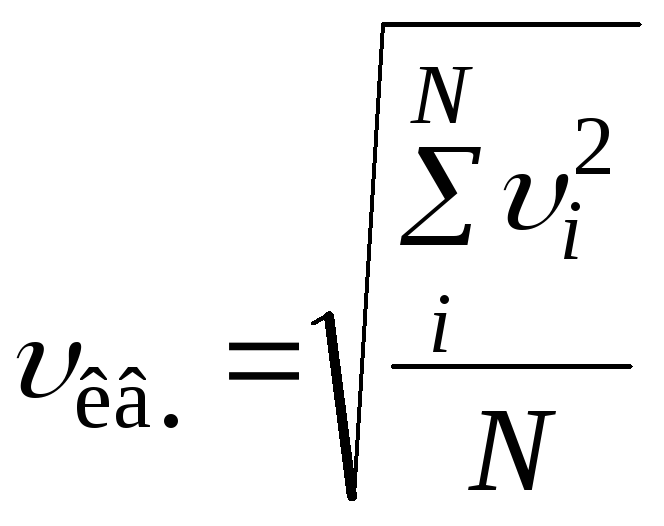 ,
,
где N – число молекул; суммирование происходит по всем молекулам. Или:
![]() ,
,
где
![]() – масса молекулы;
– масса молекулы;
![]() –
постоянная Больцмана; Т
–
термодинамическая температура
µ
–
молярная масса газа;
–
постоянная Больцмана; Т
–
термодинамическая температура
µ
–
молярная масса газа;
![]() –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
![]() Универсальная
газовая постоянная равна
Универсальная
газовая постоянная равна
![]() ,
,
где
k
– постоянная Больцмана; ![]() – число Авогадро.
– число Авогадро.
![]() Уравнение
состояния идеального газа (уравнение
Менделеева-Клапейрона:
Уравнение
состояния идеального газа (уравнение
Менделеева-Клапейрона:
![]() ,
или
,
или
![]() ,
,
где
m
– масса газа; µ
–
его молярная масса; Т
–
термодинамическая температура;
![]() – количество вещества;R
–
универсальная газовая постоянная.
– количество вещества;R
–
универсальная газовая постоянная.
![]() Термодинамическая
температура (температура по шкале
Кельвина):
Термодинамическая
температура (температура по шкале
Кельвина):
![]() ,
,
где t – температура в градусах Цельсия.
![]() Давление
газа равно:
Давление
газа равно:
![]() ,
,
где k – постоянная Больцмана; n – концентрация молекул, Т термодинамическая температура.
![]() Закон
Дальтона.
Давление
смеси идеальных газов равно сумме
парциальных давлений входящих в смесь
газов:
Закон
Дальтона.
Давление
смеси идеальных газов равно сумме
парциальных давлений входящих в смесь
газов:
 ,
,
где
![]() – номер компоненты смеси;
– номер компоненты смеси;![]() – еёпарциальное
давление,
то есть то давление, которое производил
бы данный сорт газа, если бы только один
занимал весь объём, равный полному
объёму смеси;
K
–
число компонентов смеси.
– еёпарциальное
давление,
то есть то давление, которое производил
бы данный сорт газа, если бы только один
занимал весь объём, равный полному
объёму смеси;
K
–
число компонентов смеси.
![]() Массовая
доля
i-го
компонента смеси газов
Массовая
доля
i-го
компонента смеси газов
![]() ,
,
где mi – масса i-го компонента смеси; m – масса смеси.
![]() Основное
уравнение молекулярно-кинетической
теории
Основное
уравнение молекулярно-кинетической
теории
– для давления:
![]() ;
;
– для температуры:
![]() ,
,
где
![]() – средняя кинетическая энергия
поступательного движения молекул газа.
– средняя кинетическая энергия
поступательного движения молекул газа.
![]() Теорема
о равнораспределении энергии по степеням
свободы. На любую степень свободы
приходится в среднем одинаковая энергия,
равная
Теорема
о равнораспределении энергии по степеням
свободы. На любую степень свободы
приходится в среднем одинаковая энергия,
равная
![]() .
.
![]() Число
степеней свободы
Число
степеней свободы
![]() равно
числу независимых координат, однозначно
определяющих положение тела (или
молекулы) в пространстве.
Для одноатомных молекул
равно
числу независимых координат, однозначно
определяющих положение тела (или
молекулы) в пространстве.
Для одноатомных молекул
![]() ,
для двухатомных
,
для двухатомных![]() ,
для произвольных жёстких многоатомных
–
,
для произвольных жёстких многоатомных
–![]() .
.
![]() Средняя
энергия одной молекулы, у которой
Средняя
энергия одной молекулы, у которой
![]() степеней свободы, равна
степеней свободы, равна
![]() .
.
![]() Внутренняя
энергия U
идеального газа:
Внутренняя
энергия U
идеального газа:
![]() ,
,
где i – число степеней свободы молекул газа.
