
- •Глава 18 патофизиология почек
- •18.1. Характеристика процессов, лежащих в основе работы почек
- •Часть III. Патофизиология органов и систем
- •18.2. Показатели экскреторной функции почек в норме
- •18.3. Неэкскреторные функциипочек
- •18.4. Определение размеровпочечного кровотока
- •Часть III. Патофизиология органов и систем
- •18.5. Нарушение клубочковой фильтрации
- •18.6. Нарушение функции канальцев
- •Часть III. Патофизиология органов и систем
- •18.7. Роль почек в регуляции обмена электролитов и его нарушениях
- •18.8. Роль почек в обмене воды и его нарушениях
- •Часть III. Патофизиология органов и систем
- •18.9. Роль почек в поддержании кислотно-основного равновесия и его нарушениях
- •Часть III. Патофизиология органов и систем
- •18.10. Ренальные и экстраренальные нарушения при заболеваниях почек
- •18.10.1. Ренальные нарушения
- •Часть III. Патофизиология органов и систем
- •Глава 18 / патофизиология почек
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Глава 18 / патофизиология почек
- •Часть III. Патофизиология органов и систем
- •Глава 18 / патофизиология почек
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •18.13. Гломерулонефриты
- •Часть III. Патофизиология органов и систем
- •18.14. Пиелонефрит
- •18.15. Почечнокаменная болезнь (нефролитиаз)
- •Часть III. Патофизиология органов и систем
- •Глава 18 / патофизиология почек
- •Глава 19 патофизиология эндокринной системы
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Глава 19 / патофизиология эндокринной системы
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Глава 20 патофизиология нервной системы
- •Часть III. Патофизиология органов и систем
- •20.1.6. Инкубационный период
- •Часть III. Патофизиология органов и систем
- •20.2. Типовые патологические процессы в нервной системе
- •20.2.1. Дефицит торможения. Растормаживание
- •20.2.2. Экспериментальные и клинические проявления растормаживания
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Глава 20 / патофизиология нервной системы
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •20.4. Генераторы патологически усиленного возбуждения (гпув)
- •20.4.1. Понятие и общая характеристика
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Глава 20 / патофизиология нервной системы
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •20.9.7. Принципы лечения патологической боли
- •Глава 20 / патофизиология нервной системы
- •Глава 21 патофизиология высшей нервной деятельности
- •1904 Г.
- •Часть III. Патофизиология органов и систем
- •21.1. Причины возникновения функциональной патологии
- •21.2. Проявления функциональной патологии внд
- •21.3. Механизмы возникновения патологии внд
- •Часть III. Патофизиология органов и систем
- •21.4. Типы внд
- •21.5. Информационная патология внд
- •Часть III. Патофизиология органов и систем
- •21.6. Саморегуляция поведения
- •Часть III. Патофизиология органов и систем
- •21.7. Посттравматическая патология внд
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть III. Патофизиология органов и систем
- •Часть I. Общая нозология (Адо а.Д., Новицкий в.В.)Глава I. Общее учение о болезни 25
- •Глава 2. Болезнетворные факторы внешней среды (Адо а.Д., Новицкий в.В.) 42
- •Глава 3. Местные и общие реакции организма на повреждение 66
- •Глава 4. Роль наследственности, конституции и возраста в патологии 102
- •Глава 5. Реактивность и резистентность организма, их роль в патологии
- •Глава 6. Роль иммунной системы в патологии (Климов в.В.) 150
- •Глава 7. Аллергия (Порядин г.В.) 164
- •Глава 9. Воспаление (Клименко н.А.) 207
- •Глава 10. Лихорадка (Лаврова b.C.) 235
- •Глава 11. Патофизиология типовых нарушений обмена веществ 245
- •Глава 12. Патофизиология тканевого роста (Адо а.Д.) 358
- •Часть III. Патофизиология органов и систем
- •Глава 13. Патофизиология системы крови (Гольдберг е.Д., Новицкий в.В.) 404
- •Глава 14. Патофизиология сердечно-сосудистой системы (Лишманов ю.Б., Маслов л.Н.,Пирогова н.П.) 451
- •Глава 15. Патофизиология дыхания 503
- •Глава 16. Патофизиология пищеварения (Белобородова э.И.) 538
- •Глава 18. Патофизиология почек (Лаврова b.C.) 598
- •Глава 19. Патофизиология эндокринной системы 624
- •Глава 20. Патофизиология нервной системы (Крыжановский г.Н.) 654
- •Глава 21. Патофизиология высшей нервной деятельности (Хананашвили м.М.) 688
Часть III. Патофизиология органов и систем
Одновременно
при этом заболевании снижается
чувствительность соответствующих
центров гипоталамуса и аденогипофиза
к кортизолу, что нарушает работу механизма
обратной связи, в результате чего
повышенная концентрация кор-тизола в
крови не угнетает секреции кортиколи-берина
в гипоталамусе и продукции
адренокор-тикотропного гормона (АКТГ)
в гипофизе.
Важным фактором нарушения регуляции эндокринной системы являются сосудистые поражения. Так, например, иногда при поражении портальных сосудов срединного возвышения возникают ишемия гипофиза и его некроз. Это ведет к развитию гипопитуитаризма и выпадению второй ступени трансгипофизарной регуляции желез.
Нарушение парагипофизарной регуляции. Парагипофизарный путь является главным образом нервно-проводниковым. Через этот путь осуществляется секреторное, сосудистое и трофическое влияние центральной нервной системы на функцию желез внутренней секреции. Для мозгового слоя надпочечников, островков Лан-герганса и паращитовидных желез это важнейший путь регуляции. В функции других желез играют роль оба пути регуляции. Так, например, функция щитовидной железы определяется не только выработкой ТТГ, но и симпатической импульсацией. Прямое раздражение симпатических нервов увеличивает поглощение йода железой, образование тиреоидных гормонов и их освобождение. Денервация яичников вызывает их атрофию и ослабляет реакцию на гонадотропные гормоны.
Нарушения транс- и парагипофизарной регуляции являются важнейшим механизмом дисфункции желез внутренней секреции. Выделяют различные варианты нарушений функции железы. Гипофункцией обозначают снижение образования гормонов данной железой, гиперфункцией - усиление их образования. При нарушении функции одной железы говорят о моногланду лярном процессе, расстройство функций нескольких желез обозначают как плюриглан-дулярный процесс. Нарушения функции железы могут быть парциальными, когда страдает образование какого-либо одного из нескольких секретируемых железой гормонов (например, в надпочечниках), либо тотальными, когда нарушается образование всех секретируемых железой гормонов. Нередко нарушение функций же-
лез сопровождается вовлечением в патологический процесс центров вегетативной нервной системы. Примером последнего является адипозо-генитальная дистрофия. При этом заболевании находят изменения в паравентрикулярных и вентромедиальных ядрах гипоталамуса, что приводит к снижению образования гонадотропинов и развитию гипогонадизма, а также повышенного аппетита с развитием ожирения. Патогенез ожирения сложен. В нем играют роль: а) недостаточное образование в гипофизе (или освобождение) жиромобилизующих полипептидов или тех фрагментов молекул СТГ и АКТГ, которые активируют мобилизацию жира из жировых депо, повышают содержание жирных кислот в крови и стимулируют их окисление; б) поражение трофических центров гипоталамуса, что снижает активирующее действие симпатической нервной системы на мобилизацию жира из жировых депо; в) усиление образования или активности инсулина, который стимулирует переход углеводов в жиры.
Роль механизма обратной связи. Независимо от патогенетического пути нарушения функции желез внутренней секреции, как правило, в той или иной степени страдает механизм обратной связи, и это нарушение может стать причиной других расстройств. Механизм обратной связи является обязательным звеном в саморегуляции деятельности желез. Сущность регуляции заключается в том, что регулируемый параметр оказывает обратное влияние на активность железы. По характеру регулируемого параметра механизмы обратной связи можно разделить на два типа.
Первый тип - регулируемым параметром является концентрация гормона в крови. Механизм саморегуляции заключается в том, что повышение концентрации гормона в крови тормозит активность гипоталамического центра, секрети-рующего либерины. Это приводит к снижению образования тройного гормона и, следовательно, к уменьшению образования гормона. При уменьшении концентрации гормона возникает обратная ситуация. Так осуществляется регуляция секреции кортизола, тиреоидных и половых гормонов.
Второй тип - регулируемым параметром является содержание регулируемого вещества, например концентрация глюкозы в крови или ионов кальция. В этих случаях активность же-
625
лезы
определяется концентрацией регулируемого
вещества, которое действует непосредственно
на данную железу. Знание типа механизма
обратной связи важно для
патофизиалогического анализа
нарушений и выяснения их механизмов.
Допустим, при обследовании двух больных
сахарным диабетом выявлены два вида
изменений в механизме обратной связи.
В первом случае в крови оказались
увеличенными концентрация инсулина и
глюкозы, а во втором - только глюкозы,
а концентрация инсулина снижена. В
обоих случаях увеличение концентрации
глюкозы свидетельствует об инсулиновой
недостаточности. Однако в первом
случае концентрация инсулина
увеличена. Следовательно, функция
железы не нарушена, а действие инсулина
блокируется где-то на периферии, вне
железы, т.е. речь идет о внепанкреатическом,
так называемом инсулиннезависимом
сахарном диабете. Во втором же случае
повышение концентрации глюкозы
сопровождается снижением концентрации
инсулина, что дает основание говорить
о недостаточной функции островков
Лангерганса и, следовательно, предполагать
возможность инсу-линзависимого сахарного
диабета.
Механизм обратной связи включается и при лечении гормонами. Тогда вводимый извне гормон тормозит функцию соответствующей железы и при длительном введении приводит к ее атрофии. Об этом очень важно помнить при лечении кортикостероидными гормонами. Они применяются с лечебной целью очень широко и нередко длительно, что приводит к атрофии коры надпочечников. Известно, что стрессовые состояния в связи с действием на организм различных повреждающих факторов (операционная или бытовая травма, холод, токсины, аллергическая альтерация и др.) сопровождаются активацией функции коры надпочечников и усилением секреции кортикостероидов. Это позволяет организму приспособиться к новым условиям. Больные, которые лечились кортикостероидами и прекратили это лечение, также могут попасть в такую ситуацию, когда под влиянием повреждающих факторов у них разовьется стрессовое состояние. Однако в отличие от здоровых у лечившихся кортикостероидами атрофированные надпочечники не отвечают адекватным усилением секреции кортикостероидов. В результате развивается острая надпочечниковая недостаточность, которая может закончиться гибелью больного.
626
При нарушении центральных механизмов регуляции также нарушается механизм обратной связи. Нередко этот механизм отключается, и изменение концентрации гормона в крови уже не изменяет секреции рилизинг-фактора. Выше, например, уже указывалось, что при болезни Иценко - Кушинга снижается чувствительность гипоталамических центров, воспринимающих колебания концентрации кортизола в крови. В этих случаях обычная концентрация кортизола не тормозит образования кортиколиберина, а это ведет к увеличению его образования и, соответственно, к увеличению секреции АКТГ. Для оценки функции желез, имеющих трансгипофи-зарную регуляцию, важно определять концентрацию тройного гормона в крови. Это может помочь установить локализацию патологического процесса. Так, например, при гипотиреозе значительное увеличение концентрации ТТГ (в 4-10 раз) свидетельствует о поражении щитовидной железы, которая не реагирует на ТТГ, а снижение его концентрации до следовых количеств заставляет предполагать локализацию процесса в гипофизе или в центральной нервной системе.
19.1.2. Патологические процессы в самой железе
Различные патологические процессы могут развиваться в самой железе и тем самым вызывать нарушение ее функции.
Инфекционные процессы и интоксикации
Острые инфекционные заболевания могут приводить к нарушению функции желез внутренней секреции. Так, например, менингокок-ковая инфекция может сопровождаться кровоизлиянием в надпочечники, что приводит к разрушению ткани железы и развитию острой над-почечниковой недостаточности. Подобная недостаточность может возникать при дифтерии в связи с коагуляционными некрозами в надпочечниках. Эпидемический паротит у взрослых мужчин часто вызывает орхит, который в 30-50 % случаев заканчивается одно- или двусторонней атрофией яичек. Тестикулы могут поражаться и при гонорее в связи с восходящей инфекцией уретры. Такие инфекционные заболевания, как туберкулез и сифилис, также пора-Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
жают различные железы. При туберкулезе идет постепенное разрушение ткани железы в связи с творожистым некрозом туберкулезных бугорков, а при сифилисе - в связи с некрозом сифилитической гранулемы (гуммы). При локализации процесса в надпочечных железах развивается хроническая надпочечниковая недостаточность, которая называется аддисоновой болезнью по имени врача Аддисона, впервые описавшего это заболевание. При локализации процесса в тестикулах развивается гипогонадизм, характеризующийся снижением образования андроге-нов и нарушением сперматогенеза. При локализации в паращитовидных железах развивается гипопаратиреоз и т.д.
Опухолевые процессы в железах
Это один из частых патологических процессов в железах внутренней секреции. Опухоль может развиваться в любой железе. Клиника заболевания будет определяться характером и количеством секретируемых гормонов и влиянием опухоли на окружающую ткань железы. Есть опухоли, которые не секретируют гормоны, а только сдавливают и приводят к атрофии нормальные участки железы. Клинически это будет выражаться в гипофункции соответствующей железы, как, например, при хромофобных аденомах гипофиза. Среди других опухолей гипофиза эта опухоль встречается чаще всего. Она не секретирует гормоны, но сдавливает гипофиз, вызывая его гипофункцию. Уменьшается секреция тропных гормонов, что приводит к гипофункции половых желез, щитовидной железы и надпочечников. Одновременно она может сдавливать зрительные нервы и хиазму. Это приводит к выпадениям полей зрения вплоть до полной слепоты.
Чаще всего развитие опухоли сопровождает-
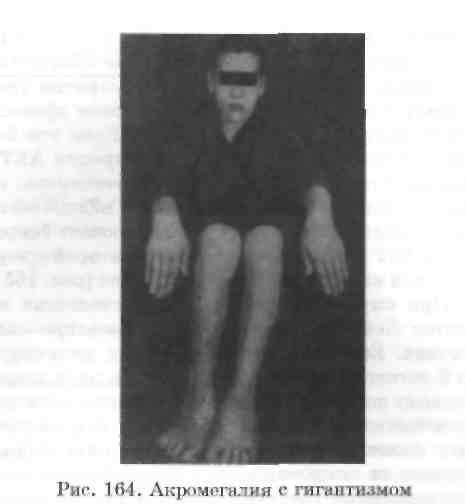
ся избыточным образованием гормона и клиникой гиперфункции. Так, например, при эозино-фильной аденоме гипофиза - опухоли, происходящей из эозинофильных клеток, продуцируется избыточное количество СТГ. В период роста организма это приводит к развитию гигантизма, а после окостенения эпифизарных хрящей -к акромегалии (от греч. akros - крайний, megas -большой). В последнем случае происходит непропорциональное увеличение и утолщение концевых частей скелета (кисти рук, стопы ног) и костей черепа вследствие периостального роста (рис. 164). Одновременно увеличиваются внутренние органы.
При базофильной аденоме гипофиза - опухоли из базофильных клеток, продуцируется избыточное количество АКТГ. Это приводит к увеличению секреции кортизола надпочечными железами и развитию синдрома гиперкортизо-лизма. Данный же синдром может быть вызван

и опухолью пучковой зоны коры надпочечников, которая секретирует избыточные количества кортизола. Определенная роль в развитии указанных изменений при этом синдроме принадлежит механизму обратной связи. Если при ба-зофильной аденоме избыточная секреция АКТГ вызывает гиперплазию обоих надпочечников, то при опухоли пучковой зоны одного надпочечника механизм обратной связи выключает секрецию АКТГ и это ведет к тому, что второй - нормальный надпочечник - атрофируется (рис. 165).
При опухолях тестикул, происходящих из клеток Лейдига, усиливается образование анд-рогенов. Если опухоль возникает у мальчиков до 9-летнего возраста, то это ведет к преждевременному половому созреванию, характеризующемуся быстрым ростом тела и развитием вторичных половых признаков. Однако опухолевый процесс не сопровождается сперматогенезом и непораженные участки железы остаются незрелыми.
Опухоли сетчатой зоны коры надпочечников продуцируют гормоны, обладающие андро-генными и эстрогенными свойствами, и приводят к развитию адреногенитальных синдромов (см. ниже).
Иногда опухоли поражают несколько эндокринных желез. Описаны аденомы, одновременно развивающиеся в аденогипофизе, паращито-видных железах и островках поджелудочной железы. Одна или все они могут быть гормонально активными, и клиника будет зависеть от количества и вида секретируемых гормонов. Иногда этот синдром носит семейный характер и сопровождается развитием пептических язв. Примером является синдром Золлингера - Эллисона (синдром ульцерогенных аденом островков Лангерганса). Его развитие связано с наличием гастринсекретирующей опухоли поджелудочной железы, вызывающей высокую желудочную секрецию соляной кислоты, развитие пептических язв и диарею.
Железа внутренней секреции может быть не только источником опухоли, но и местом, куда метастазируют опухоли из других органов. В этих случаях растущая опухоль будет сдавливать железу, вызывать ее атрофию и гипофункцию. Так, при метастазе рака молочной железы в заднюю долю гипофиза нарушается выделение ан-тидиуретического гормона (АДГ) и развивается несахарный диабет. Рак легкого, помимо костей, дает метастазы в надпочечники, а рак желудка -
628
нередко в яичники (так называемый крукенберг-ский рак яичников).
Иногда опухоли эндокринных желез или даже неэндокринных органов начинают продуцировать гормоны, не свойственные данной железе или вообще клеткам данного органа. Например, опухоль щитовидной железы или бронхогенный рак начинает продуцировать АКТГ с развитием, как следствие, синдрома гиперкортизолизма. Такое изменение фенотипа клеток связано с природой их опухолевой трансформации, во время которой происходит дерепрессия таких участков генома клетки, которые у дифференцированных клеток не функционируют.
Генетически обусловленные дефекты биосинтеза гормонов
Биосинтез любого гормона представляет собой сложный и многозвеньевой процесс, в котором принимают участие многие ферменты. Образование же любого фермента, точнее его апо-фермента, определяется активностью соответствующего гена. Мутация гена может привести к выпадению образования апофермента или такому его изменению, при котором образующийся фермент теряет свою активность. В таком случае будет нарушен последовательный ход биосинтеза соответствующего гормона. Это приводит к трем следствиям: 1) развивается гипофункция железы; 2) в железе накапливаются промежуточные продукты биосинтеза, образующиеся до места блокады. Они, как правило, начинают выделяться в кровь и оказывают специфический патофизиологический эффект; 3) нарушается работа механизма обратной связи, что может приводить к развитию дополнительных патологических процессов. Иллюстрацией к этому положению служат следующие примеры. На схеме 36 в самых общих чертах представлен биосинтез кортизола.
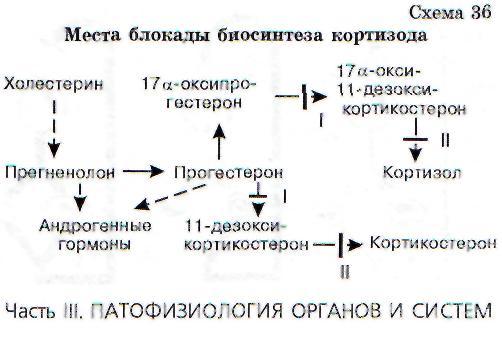
В настоящее время хорошо изучены два вида блокады образования кортизола в связи с дефицитом ферментов - 21-гидроксилазы (I) в одном случае и 11 (5-гидроксилазы (II) - в другом. При дефиците 21-гидроксилазы (I) процесс биосинтеза заканчивается образованием прогестерона и 17а-оксипрогестерона. Кортизол не образуется. Это по механизму обратной связи растормаживает секрецию кортиколиберина в гипоталамусе, что, в свою очередь, ведет к усилению образования АКТГ. АКТГ стимулирует стерои-догенез до места блокады, и так как кортизол не образуется, то вся эта стимуляция переключается на образование Б4-андростен-3,17-диона, обладающего андрогенными свойствами. Его поступление в кровь значительно увеличивается. Образующиеся в надпочечниках андрогены включаются в механизм обратной связи, регулирующей развитие половых желез, и приводят к выключению этой регуляции, что сопровождается атрофией половых желез как у мальчиков, так и у девочек. Дефект выявляется уже в период
эмбрионального развития. У эмбриона женского пола к этому периоду внутренние половые органы уже заложены, поэтому избыток андрогенов вызывает их гипоплазию и развитие вирилизма. Маскулинизация продолжается и после рождения. У мальчиков же появляются признаки преждевременного полового созревания.
Подобный механизм включается и при дефекте фермента 11 Р-гидроксилазы (II). В этом случае кортизол также не образуется, но в отличие от предыдущего синдрома здесь накапливается избыточное количество 11-дезоксикортикостеро-на и 17а-окси-11-дезоксикортикостерона, первый из которых обладает выраженными минерало-кортикоидными свойствами. Это ведет к повышению кровяного давления. Всю эту патогенетическую цепь можно разорвать введением глю-кокортикоидов (рис. 166). Они тормозят образование АКТГ и тем самым уменьшают образование андрогенов.
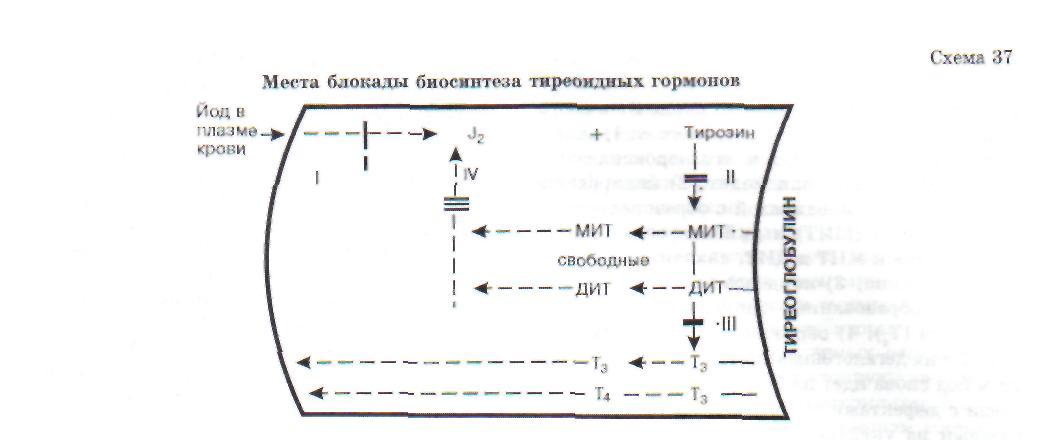
Другой пример. Биосинтез тиреоидных гормонов, происходящий в клетках фолликулярно-

629
го
эпителия щитовидной железы, также
является сложным многозвеньевым
процессом. В общих чертах он представлен
на схеме 37 и состоит из следующих
основных процессов: 1) захват йода железой
и окисление его пероксидазой в молекулярный
йод или йодит; 2) йодирование тирозина
тирозинйодиназой с образованием
мо-нойодтирозина (МИТ) и дийодтирозина
(ДИТ); тирозин, как и МИТ и ДИТ, находится
в составе тиреоглобулина; 3) конденсация
молекул МИТ и ДИТ с образованием
трийодтиронина (Т3)
и тироксина (Т4);
4) образование свободных МИТ и ДИТ и их
дегалогенизация; выделяющийся при этом
йод снова идет на йодирование тирозина.
В связи с дефектами соответстиующих
ферментов каждый из указанных этапов
может блокироваться.
Установлена возможность блокады йодзахва-тывающей системы (I). Для этого случая характерна неспособность железы поглощать J131 при соответствующем исследовании. Исправление этого дефекта достигается введением в организм небольших доз йодистого калия, который в связи с повышением его концентрации в крови, в силу диффузии проникает в щитовидную железу и, таким образом, компенсирует дефект йод-захватывающей системы. II - блокада йодирования тирозина. Поглощенный йод сохраняется в железе в неорганической форме и не включается в тирозин. Этот дефект пока компенсируется введением готовых тиреоидных гормонов. III -дефект конденсации йодтирозинов. Характеризуется накоплением промежуточных продуктов - МИТ и ДИТ и следовыми количествами Т3 и Т4. Компенсация дефекта проводится также введением гормонов. IV - дефект йодтирозин-дега-логеназы. Характеризуется угнетением дегало-генизации МИТ и ДИТ. Эти продукты накапливаются, выделяются в кровь и выводятся из организма. Организм теряет йод, развивается йодная недостаточность. Компенсация дефекта может быть обеспечена введением в организм йодистого калия.
Каждый из указанных дефектов приводит к недостаточному образованию тиреоидных гормонов. В результате возникает гипофункция щитовидной железы, сопровождаемая развитием зоба (увеличением щитовидной железы) и кретинизма. Последнее объясняется тем, что эти дефекты возникают еще до рождения или в детском возрасте.
630
19.1.3. Периферические (внежелезистые) механизмы нарушения активности гормонов
Большую роль в развитии эндокринных и ряда других заболеваний играют периферические механизмы, определяющие активность уже выделившихся в кровь гормонов. Эта активность может изменяться либо в сторону ее повышения, либо снижения, что клинически будет выявляться как гипер- или гипофункция соответствующей железы. Чтобы ясно представить себе возможные механизмы нарушения активности гормонов, разберем в общих чертах судьбу выделившихся гормонов и механизм их действия.
Очевидно, все выделившиеся из желез гормоны связываются в крови в той или иной степени с определенными белками и циркулируют в крови в двух формах - связанной и свободной. Из этих двух форм связанный гормон биологически неактивен. Активностью обладает только свободная форма гормона, которая и оказывает физиологическое действие в клетках-мишенях. Известно связывание белками тироксина, инсулина, гормона роста, стероидных гормонов. Так, например, в физиологических условиях в плазме крови кортизол и кортикостерон связаны белками более чем на 90% и лишь незначительное количество этих кортикостероидов находится в свободном состоянии,
Общее количество циркулирующего тироксина в организме составляет: связанного - 1,0 мг, свободного - 0,001 мг при концентрации последнего в сыворотке крови 0,1 мкг/л. Таким образом, концентрация свободной формы гормона очень незначительна по отношению к связанной.
Механизм действия гормонов на уровне клеток-мишеней различен и сложен. По современным представлениям все гормоны по механизму их действия на клетки-мишени можно разделить на две группы. Одна группа гормонов управляет различными обменными процессами в клетке с её поверхности, как бы на расстоянии. Поэтому данную группу гормонов можно назвать гормонами «дистантного» действия. Сюда входят белковые и пептидные гормоны, факторы роста, катехоламины, а также ряд других лигандов. Эти гормоны связываются на поверхности клетки-мишени с соответствующим рецептором, что включает ряд биохимических процессов, приводящих к образованию вторичных посредников. Обычно это выражается в активации ферментов-
