
- •Механизм:
- •Нитриты
- •Гидразиды
- •3) Из сл.Эфиров
- •Дикарбоновые кислоты
- •Ненасыщенные дикарбоновые кислоты
- •Ароматические дикарбоновые кислоты
- •Сульфоновые кислоты
- •Ароматические (фенолокислоты)
- •Производные солициловой кислоты
- •1) Произ-ые по –cooh:
- •2) Ппроизв-ые по –oh:
- •Оксокислоты
- •Алкилирование
- •Природные α-аминокислоты
- •Специфич.Св-ва аминокислот.
- •Пептиды и белки
- •С троение пептидной группы
- •Химический метод синтеза пептидов(классич)
- •Твердофазный синтез пептидов (тфсп)
- •Важнейшие пентозы:
- •Важнейшие гeксозы:
- •Стереоизомерия
- •Таутомерия
- •Конформации моносахаридов.
- •Конформация галактоперонозы
- •Химические св-ва моносахаридов.
- •Качественные реакции обнаружения гексоз., и пентоз.,
- •Другие представители моносахаридов.
- •Аминосахара
- •Дисахариды
- •Химические св-ва:
- •Полисахариды
- •Крахмал
- •Аминопектин
- •Декстраны
- •Пособы получения:
- •Галогенирование
- •Специфич.Реакции
- •Пятичленные гетероциклы с 2-мя гетероатомами
- •Имидазол. Получение:
- •Важнейшие производные:
- •Производные пиразола.
- •3(5)-Оксипиразол пиразолон-3(5)
- •Синтез антипирина
- •Синтез амидо из антипирина
- •Хинолин
- •Производные хинолина
- •Производные пиримидина
- •Синтез барбитуровой к-ты.
- •Оксазины
- •Тиазины
- •Производные фенотиазина
- •Мочевая к-та.
- •Метилированные ксантины
- •Птеридин
- •Аллоксазин изоаллоксазин.
- •Алкалоиды
- •**Морфин
- •** Кокаин
- •Нуклеиновые ( азотистые основания)
- •Нуклеозиды:
- •Нуклеотиды
- •2 Цепи в этой спирали антипараллельны, т.Е.Их 5’ и 3’-межнуклеотидные фосфодиэфир.Мостики параллельны противоположно.
- •Коферментные нуклеотиды
- •2)Флавиновые ( фмн и фад)
- •Терпены
- •Циклические
- •Производные камфана :
- •Стероидные гормоны (половые г.И г.Коры надпочечников)
- •Желчные кислоты
- •Стерины
- •Омыляемые липиды
- •Простые липиды
- •Обзорная лекция
- •Задачи:
Производные пиразола.
Пиразолоны
H O- N прототроп.таутом. HO NH лактим.лактам. O = N-H





N N: N
H H
3(5)-Оксипиразол пиразолон-3(5)
** Антипирин
CH3
O= N-CH3 2.3-диметил-1-фенил-пиразолон3(5)
N
C6H5
** Амидопирин
N(CH3)2 CH3
O= N-CH3
N
C6H5
(2,3-диметил-1-фенил-4-диметиламинопиразолон -3(5)
** Анальгин
 NaO3S-CH2-N-CH3
CH3
NaO3S-CH2-N-CH3
CH3
O= N-CH3
 N
N
C6H5
Жаропониж.и болеутоляющие препараты
**Бутадион ( противовосп.препарат)
C
 4H9
O
4H9
O
O = N-C6H5
N
C6H5
1,2-дифенил -4- бутил-пиразолидиндион -3,5
Синтез антипирина



 CH2-C-CH3
CH2-C-CH3
CH2-C-CH3
CH2-C-CH3
CH2-C-CH3
CH2-C-CH3
O



 =C
O O=C N
-C2H5
O=C N
=C
O O=C N
-C2H5
O=C N
C

 2H5O
+ H2N
H5C2-O
H-N-C6H5
N
2H5O
+ H2N
H5C2-O
H-N-C6H5
N
NH-C6H5 C6H5
Ацетоуксус. фенилгидридразин
эфир
 H J
H J
 HC CH3
CH –
C-CH3
HC CH3
CH –
C-CH3
+СH3J O= N-CH3 -HJ C N-CH3
N N
C6H5 c6H5
Синтез амидо из антипирина
CH3 NO2 CH3 NH3 CH3
O
 =
N-CH3
HNO3
O= N-CH3
[H] O= N-CH3
+2CH3J
=
N-CH3
HNO3
O= N-CH3
[H] O= N-CH3
+2CH3J
-H2O -H2O -2HJ
N N N
C6H5 C6H5 C6H5
4-аминоантипирин
N(CH3)2 CH3
O= N-CH3
N
C6H5
Качеств.их можно различить с помощью азотистой к-ты и FeCl3 ( см.практикум)
Тиазол
Производные
** Вход в состав вит.В1

 NH2
N+
CH3
NH2
N+
CH3
 N CH2
- CH2CH2OH
N CH2
- CH2CH2OH


H3C N S
Тиазольное кольцо
**2-аминотиазол исп-ся в произв-ве лек.средств.

 O N
O N

 H2N
-S-NH-
H2N
-S-NH-
 O
O
S
** Тиазолидин вход.в сост.пинициллина
H2C N-H
H2C CH2
S
Общая формула пинициллина.
H

 OOC
N O
OOC
N O



 H3C
NH-C-R
H3C
NH-C-R
 CH3 S
CH3 S
Β-лактамное кольцо
Тиазомидиновое
Кольцо
Шестичл.гетероциклы с 1-ми гетероатомом.










 N
N
N N
Пиридин хинолин изохинолин
Азины
Все яв-ся ароматич, но в отл.от 5-ти членных неподел.пара е- N не учавств.в сопряж.
Пиридин
Азот проявляет ЭА характер, это П-недостаточная система.
4(б)
(β’)5 3(β)
(α’)6 2(α)
N
..1
П олучение:
олучение:
1
 )
2CHaCH+HCN
–4000о
)
2CHaCH+HCN
–4000о
2
 )
2CHaCH+NH3
4000о
)
2CHaCH+NH3
4000о
Al2O3 N
3
 )
CH3-C=O
+ NH3
+ H-C=O –to
)
CH3-C=O
+ NH3
+ H-C=O –to
H H
По Чичибабину
Хим.св-ва:
** основные
Связаны с наличием свободной пары е- у атома N.
Основность пиридина меньше, им у алифат.аминов, в пиридине пара е- занимает sp2 гибр.орбиталь, а в аминах sp3 , т.к. ЭО N в sp2 > ЭО N в sp3 гибр.
- реаг.с водой



 +
+


 +Hб+OHб-
OH-
лакмус-синеет
+Hб+OHб-
OH-
лакмус-синеет

 ..N
N
..N
N
- реаг.как с мин.к-ами, так и с орг.-пикриновой к-ой, α-ая исп-ся для идентиф.пиридина.



 +
+
+ HBr Br-


N N
H

 OH
OH

 O2N
NO2
+ NO2
O2N
NO2
+ NO2
 +
N-H O-
- NO2
+
N-H O-
- NO2
N NO2 NO2
Пикрат пиридинил
**реак.электрофильного замещения,т.к.N проявл.ЭА характер,поэтому пиридин, по сравн.с бензолом, яв-ся
П-недост.системой.
Реак. SE идут труднее, чем у C6H6.
Кроме того в кисл.среде, кольцо более дезактивируется, из-за обр-ия пока пиридиния.

 Br 300o
Br
реак SE идут в В-положении.
Br 300o
Br
реак SE идут в В-положении.

 Галоген
-HBr
Галоген
-HBr

 N
N
N
 KNO3+H2SO4;
300о
NO2
KNO3+H2SO4;
300о
NO2
нитрировние
-K2SO4 -H2O
N
H2SO3 SO3; 200o SO3H
 Сульфир
B-пиридинсульфо
к-та
Сульфир
B-пиридинсульфо
к-та
N
**реак. Sn
Если для C6H6 реак. SN вообще не идут, то у пиридина эти реак.идут в α-положении. Если это полож.занято, то в γ-полож.

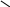

 NaNH2, to
NaNH2, to
 Аминиров.
HOH
Аминиров.
HOH
б

 +
-Н2
NHNa -NaOH
NH2
+
-Н2
NHNa -NaOH
NH2
N N N α-амигопиридин
 KOH, to
KOH, to
Гидроксил.
-Н2 OH HOH OH
N N
Для гидроксипроизв.хар-на лактил-лактанная таутомерия.



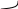
 OH
=O
OH
=O
 ..N
N
..N
N
Лактимная форма лактамная форма
Преоблад.в р-ре, т.к:
1) средство к протоку у ат.N, больше чем к О.
2) цепь сопряж.длинее
**Nu св-ва.
Связана с налич.свобод.пары е- ат N.
1) алкилирование




 + CHб+3Jб-
+ CHб+3Jб-

 J- иодистый
N-метилперединин
J- иодистый
N-метилперединин
..N N+
CH3
2)ацилирование








 + CH3C=O
N-C-CH3
Cl - исп-ся как
хороший ацил.реагент.
+ CH3C=O
N-C-CH3
Cl - исп-ся как
хороший ацил.реагент.
..N Cl




 + SO3
N+ - SO3-
пиридин сульфотриоксид.хороший
сульфирующ.реагент.
+ SO3
N+ - SO3-
пиридин сульфотриоксид.хороший
сульфирующ.реагент.


..N
3) восстановление
В хим.повед, как со втор.амины.


 CH2
CH2
 [H]
H2C
CH2
[H]
H2C
CH2



 C2H5OH
+ Na H2C
CH2 пипиридин
C2H5OH
+ Na H2C
CH2 пипиридин
..N N
 H
H
3H2/Pt
4H2/Pt, 70атм CH3-CH2-CH2-CH2 -CH2NH2
 Пентанамин
-1
Пентанамин
-1
- Окисление
При окисл.пироксикислотами идет окисл.по N.
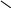

 CH3COOH
N-оксидпиридана
легкор восст.до исх.пиридина.
CH3COOH
N-оксидпиридана
легкор восст.до исх.пиридина.


 ..N
N
..N
N
O
Производные пиридина

 CH3
CH3
CH3

 CH3
CH3
N N N
Пиколины (гомологи пиридина)
α-пиколин
(2-метил-пиридин)
Α-метил-
Пиридин.
При их окисл.обр-ся к-ты.
 COOH
COOH

 COOH
COOH

 COOH
COOH
N N N
Пиколиновая к-та. Никотиновая к-та. Изоникот.к-та.
Произв.к-т
Никот.к-та и ее амид-витамин РР(антипилогрич.витам.)
В свою очередь никотин амид входит в состав коферментов: НАД + и НАДФ +, α-ые участв.в О-ВР, связанных с перкосом гидрид иона.

 C=O
C=O
 NH2
NH2
N





 [H-]
H H
[H-]
H H

 C=O + R-H
C=O
C=O + R-H
C=O
NH2 H NH2 + R + H+
N+ N
R R
НАД+ НАДН
Окисленная форма восстан.форма конфермента
Гидразит изоник.к-ты, под названием тубазид, исп.в мед.для лечения туюеркулеза.
При конденс.тубазида с ванилином получ.еще более преперата-фтевазид.

 С=O
С=O
NH-NH2
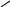
N







 N C=O
O
N C=O
O






 NH-NH2
+ O= C OH N
C-NH-N=CH OH
NH-NH2
+ O= C OH N
C-NH-N=CH OH
H OCH3 -H2O OCH3
ванилин
