
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы

7.3.10. Электрохимическая защита
Процесс электрохимического разрушения металлических конструкций в агрессивной среде является результатом ионизации металла за счет отдачи им электронов окислительному компоненту среды и переходу ионов металла в раствор.
Такой процесс можно остановить или сильно замедлить путем создания условий, затрудняющих отдачу металлом электронов (анодная защита), или путем изменения направления тока в системе металл–электролит (катодная защита). В зависимости от направления смещения потенциала металла электрохимическая защита подразделяется на катодную и анодную.
Катодная защита применима для металлов, не склонных к пассивации и сводится к тому, чтобы обеспечить на поверхности металла возможность протекания только (или преимущественно) катодных процессов путем сдвига его потенциала в отрицательную сторону.
На рис. 7.43 показана поляризационная диаграмма коррозии двухэлектродного элемента в электролите, поясняющая катодную
защиту. Точке О пересечения анодной кривой φоа –B с катодной
φок –С соответствует стационарный потенциал φх и плотность тока
коррозии jкор. Если всю систему заполяризовать до более отрицательного потенциала, например, до φ1, то плотность анодного тока уменьшится до значения j1. Анодный ток (ток коррозии) может полностью прекратиться, если систему заполяризовать до потенциала φоа .
Рис. 7.43. Поляризационная диаграмма коррозии, поясняющая катодную защиту
555

При такой катодной поляризации поляризующий ток идет, с одной стороны, на подавление анодного тока (т.е. непосредственно на защиту от коррозии), а с другой – на поляризацию катода от потенциала φх до потенциала φ1. Поэтому плотность поляризующего тока должна быть больше, чем необходимо для достижения защитного эффекта. Защитный ток должен быть тем больше, чем больше катодная поверхность, и чем меньше поляризуемость катода, как это происходит при коррозии с водородной деполяризацией.
При достаточно большой плотности приложенного внешнего тока суммарный положительный ток протекает на всей поверхности металла (включая анодные участки), следовательно, отсутствуют условия для перехода ионов металла в раствор.
При катодной защите защищаемая конструкция присоединяется к отрицательному полюсу источника постоянного тока, а положительный полюс источника тока соединяется с металлической болванкой или графитом (вспомогательный анод).
Ток от вспомогательного анода направляется в катодные и анодные участки коррозионных элементов, заполяризовывая в них катодные участки до потенциала анода, и возвращается к источнику постоянного тока. При таком присоединении разряжаться будет источник постоянного тока и разрушаться болванка металла, служащая анодом (рис. 7.44).
Рис. 7.44. Схема катодной защиты внешним током:
1 – защищаемая стальная конструкция;
2 – соединительные провода;
3 – источник постоянного тока;
4 – анод
Катодная защита возможна лишь в том случае, когда защищаемая конструкция и вспомогательный анод находятся в электронном и электролитическом контакте. Например, коррозия выше ватерлинии водяных резервуаров катодной защитой не предотвращается, так как пропускаемый ток протекает только через поверхность металла, контактирующую с электролитом. Катодной защите в условиях несильно агрессивных сред подвергаются металлические час-
556
ти и конструкции подземных и береговых сооружений, морских буровых платформ, корпуса судов, трубопроводы различного назначения, теплообменники, холодильники и т.д. Часто катодную защиту применяют в сочетании с нанесением защитных покрытий.
Катодная защита внешним током нецелесообразна в условиях атмосферной коррозии, в парообразной среде, в органических растворителях, так как в таких случаях коррозионная среда не обладает достаточной электропроводностью.
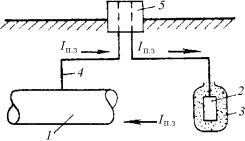
Разновидностью катодной защиты является протекторная защита. Отличие заключается в ином источнике катодной поляризации защищаемого металла. Вместо внешнего источника тока к конструкции присоединяют протектор, обычно в виде металлической пластины или цилиндра, который в данной среде обладает более электроотрицательным потенциалом, чем любой участок защищаемой конструкции. Протектор, соединенный с защищаемой конструкцией, создает короткозамкнутый гальванический элемент, который и является источником постоянного тока. Защищаемый металл перестает посылать электроны во внешнюю цепь и, наоборот, сам начинает их принимать от присоединенного протектора. Защищаемый металл становится катодом, а металл протектора – растворимым анодом (рис. 7.45).
Рис. 7.45. Схема катодной протекторной защиты: 1 – стальная конструкция;
2 – протектор; 3 – наполнитель;
4 – электрический контакт с конструкцией;
5 – контрольно-измерительное устройство
(Iп.з – ток протекторной защиты)
В качестве протектора чаще всего используют магний, цинк и их сплавы, реже алюминий, покрывающийся пассивирующей его оксидной пленкой и изолирующей протектор от окружающего электролита. Для более эффективной работы протектора (его растворения) и уменьшения переходного сопротивления между ним и электролитом вокруг протектора создают среду (наполнитель), в
557
которой разрушается пассивирующая пленка. Такой средой, например, для алюминиевых протекторов служит Ca(OH)2, а для цинковых – глина с гипсовым порошком.
Эффективность применения протектора ограничивается радиусом его действия, зависящим от электропроводности среды, разности потенциалов между протектором и защищаемой конструкцией, от их поляризационных характеристик. Например, радиус действия цинкового протектора при защите стали в дистиллированной воде составляет 0,1 см, в 0,03%-м растворе NaCl – 15 см, в морской воде 400 см. Соотношение поверхностей протектора и защищаемого металла находится в пределах от 1:200 до 1:1000. Протекторную защиту, как и катодную, целесообразно комбинировать с нанесением защитных покрытий.
Протекторная защита отличается необычайной простотой, достаточной эффективностью и рентабельностью. В некоторых случаях применение протекторов является незаменимым. Например, при защите внутренней поверхности цистерн и стальных конструкций от коррозии в морской воде.
Анодная защита применяется при эксплуатации оборудования в сильно агрессивных средах (не содержащих активирующих ионов Cl–, Br–, I–, F–) и изготовленного из легко пассивирующихся при анодной поляризации металлических материалов – углеродистых, легированных коррозионно-стойких сталей, титана, циркония и т.д. и неприменима для металлов, не склонных к пассивации.
Анодная защита, в отличие от катодной, осуществляется присоединением защищаемого изделия к положительному полюсу внешнего источника постоянного тока или к металлу с более положительным потенциалом. При этом потенциал защищаемого металла смещают в область устойчивого пассивного состояния (см.
рис. 7.36).
Анодная защита сводится к тому, чтобы обеспечить создание на поверхности металла защитной от воздействия агрессивной среды пассивирующей пленки. Катоды размещаются вблизи поверхности изделия. Их число, размеры и расстояние от изделия должны обеспечить равномерную анодную поляризацию. Используемые при анодной защите катоды должны быть устойчивы против разрушения в коррозионной среде. Выбор материала катода определяется
558
