
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
пластинчатым графитом (отсюда и название чугуна с шаровидным графитом – высокопрочный чугун). Ковкий чугун с хлопьевидным графитом занимает промежуточное положение по прочности между обычным серым и высокопрочным чугуном. Таким образом прочность чугуна (в отношении нормальных напряжений) определяется строением металлической основы и формой графитных включений.
Очень часто упоминается о вредности графитных включений. Однако в ряде случаев образование этих включений может быть полезным. Именно благодаря наличию графита чугун иногда используется вместо стали, поскольку:
-наличие графита облегчает обрабатываемость резанием, делает стружку ломкой;
-чугун обладает хорошими антифрикционными свойствами благодаря смазывающему действию графита;
-наличие графитных выделений быстро гасит вибрации и резонансные колебания;
-чугун меньше чувствителен к дефектам поверхности, надрезам и т.п., чем высокопрочная сталь;
-чугун обладает лучшими литейными свойствами по сравнению со сталью. Более низкая температура плавления и окончание кристаллизации при постоянной температуре эвтектики обеспечивают не только удобство в работе, но и лучшие жидкотекучесть
изаполняемость форм.
Описанные свойства чугуна делают его ценным конструкционным материалом, широко применяемым в деталях машин, которые не испытывают значительных растягивающих и ударных нагрузок.
5.4. Анализ сложных диаграмм фазового равновесия
Выше были рассмотрены элементы, из которых строятся двухкомпонентные диаграммы фазового равновесия, и приведены типичные простейшие диаграммы фазового равновесия с реакциями на горизонтальных линиях и с промежуточными фазами. Был проведен очень подробно анализ диаграммы Fe–С, сплавы которой к
315
настоящему времени изучены наиболее полно, если сравнивать с любыми другими диаграммами фазового равновесия.
Будет полезно ознакомиться с тем, как сочетаются эти простейшие диаграммы и элементы построения для получения и анализа диаграмм сложной конфигурации. При соединении элементов диаграмм и простейших реакций в полную диаграмму фазового равновесия должны соблюдаться следующие принципы:
-однофазные области могут соприкасаться друг с другом только в одной точке (т.е. в точке конгруэнтного превращения) и никогда по граничной линии;
-две соседние однофазные области отделяются друг от друга двухфазными областями, состоящими из этих двух фаз;
-от каждой трехфазной изотермической линии должны исходить три двухфазные области, т.е. от каждой изотермической линии должны исходить шесть граничных линий;
-любую горизонталь на диаграмме фазового равновесия можно рассматривать как три коноды, каждая из которых соединяет составы фаз, находящихся в равновесии.
Трехфазная реакция всегда протекает при постоянной температуре, при которой при охлаждении:
-или одна фаза промежуточного состава распадается на две другие крайних составов на горизонтали (эвтектическая, эвтектоидная, монотектическая, монотектоидная или метатектическая реакция);
-или при взаимодействии двух крайних на горизонтали фаз образуется третья промежуточная по составу фаза (перитектическая, перитектоидная или синтектическая реакция).
Полиморфизм. Для реакций, протекающих в твердом состоянии (эвтектоидная, монотектоидная, перитектоидная реакции), и метатектической реакции обязательным является наличие поли-
морфизма (аллотропических превращений) хотя бы у одного из компонентов. Ранее мы уже рассмотрели несколько диаграмм фазового равновесия, компоненты которых обладают двумя аллотропическими модификациями (см. рис. 5.25, 5.31, 5.32, 5.37), а в случае диаграммы Fe–С (см. рис. 5.43) железо находится в трех аллотропических состояниях. Диаграммы фазового равновесия с
316

полиморфными компонентами отличаются большим разнообрази-
ем (рис. 5.47).
аб
в
Рис. 5.47. Диаграммы фазового равновесия с наличием полиморфизма
укомпонентов:
а– с непрерывными рядами твердых α- и β-растворов между изоморфными модификациями компонентов А и В; б – с непрерывным рядом β-твердых растворов между высокотемпературной модификацией компонента А
икомпонентом В; в – с замкнутой областью α-фазы на основе полиморфного компонента А, который имеет три модификации
На рис. 5.47,а представлена простейшая диаграмма фазового равновесия с непрерывными рядами твердых α- и β-растворов между изоморфными модификациями компонентов А и В.
На рис. 5.47,б показана диаграмма с непрерывным рядом β-твердых растворов между высокотемпературной модификацией компонента А и компонентом В. Следует отметить, что при добавлении компонента В к компоненту А температуры начала и
317
конца превращения β → α снижаются, в результате чего область существования твердых растворов увеличивается. В данном случае можно сказать, что по отношению к компоненту А легирующие элементы, расширяющие область устойчивости высокотемпературной β-фазы, называют β-стабилизаторами.
На рис. 5.47,в представлена диаграмма фазового равновесия с замкнутой областью α-фазы на основе полиморфного компонента А, который имеет три модификации. Две из них (низкотемпературная и высокотемпературная β-модификации) изоморфны между собой и компоненту В, образуя с ними непрерывные ряды твердых растворов.
Анализ диаграмм. При описании всех диаграмм фазового равновесия целесообразно придерживаться определенного плана при рассмотрении процессов, происходящих в различных областях и на линиях диаграммы
1.Растворимость компонентов в жидком состоянии.
2.Полиморфизм компонентов, если это имеет место.
3.Растворимость компонентов в твердом состоянии, ее максимальное значение и характер изменения растворимости при изменении температуры.
4.Наличие каких-либо реакций на горизонтальных линиях на диаграмме с записью этих реакций.
5.Если на диаграмме имеются промежуточные фазы, дать им развернутую характеристику: их состав, наличие или отсутствие области гомогенности, конгруэнтно или инконгруэнтно плавящиеся.
Например, охарактеризуем по этому плану диаграмму фазового равновесия, приведенную на рис. 5.37,а:
1.Компоненты А и В обладают полной взаимной растворимостью в жидком состоянии.
2.Компонент А имеет две аллотропические модификации, α- низкотемпературную и γ-высокотемпературную. Компонент В также имеет две аллотропические модификации, β-низко- температурную и γ-высокотемпературную.
3.Высокотемпературные γ-модификации компонентов А и В образуют непрерывный ряд твердых растворов (или обладают полной взаимной растворимостью).
318

Компонент В растворяется в компоненте А, образуя α-твердый раствор с точкой сольвуса а (точкой, показывающей максимальную растворимость В в А). Растворимость компонента В в А уменьшается с понижением температуры.
Компонент А растворяется в компоненте В, образуя β-твердый раствор с точкой сольвуса b. Растворимость А в В уменьшается с понижением температуры.
4.При температуре T1 на линии abp наблюдается перитектоидная реакция: αa + γp → βb.
5.Промежуточных фаз на данной диаграмме не наблюдается. В начале п. 5.4 были приведены основные принципы, которые
должны соблюдаться при соединении элементов диаграмм и простейших реакций в полную диаграмму фазового равновесия. Применение этих принципов при построении сложных диаграмм иллюстрируется воображаемой диаграммой фазового равновесия на рис. 5.48, включающей многие элементы и реакции, рассмотренные в предыдущих разделах.
Рис. 5.48. Гипотетическая диаграмма 1 фазового равновесия
Охарактеризуем эту диаграмму, основываясь на ранее приведенном плане
1. Компоненты А и В обладают ограниченной растворимостью в жидком состоянии (расслоением жидкости) при температуре ниже
319
T5 в интервале концентраций между проекциями точек r и s на ось концентраций.
2. Компонент А имеет две аллотропические модификации, α- низкотемпературную и γ-высокотемпературную.
3. Компоненты А и В обладают ограниченной растворимостью в твердом состоянии.
Компонент В растворяется в γ-высокотемпературной модификации компонента А с точкой сольвуса d и в α-низкотемпературной модификации компонента А с точкой сольвуса c. Растворимость В
вα-низкотемпературной модификации компонента А уменьшается
спонижением температуры.
Компонент А растворяется в компоненте В с точкой сольвуса w. Растворимость А в В уменьшается с понижением температуры.
4. При температуре T1 на линии cde наблюдается метатектическая реакция γd → αc + Le, т.е. γ-твердый раствор состава точки d при охлаждении распадается на α-твердый раствор состава точки c и жидкость (или жидкий сплав) состава точки e.
При температуре T2 на линии fgh наблюдается перитектическая реакция αf + Lh → δg c образованием при охлаждении δ-твердого раствора на основе промежуточной фазы, которую мы назвали С1.
При температуре T3 на линии jkl происходит эвтектическая ре-
акция Lk → δj + ηl.
При температуре T6 на линии mno происходит перитектическая реакция ηm + Lo → C3 c образованием неустойчивого химического соединения состава C3.
При температуре T7 на линии prs наблюдается монотектическая
реакция (L1)r → (L2)s + (С3)p.
При температуре T8 на линии vuw происходит эвтектическая ре-
акция Lu → C3 + βw.
5. На диаграмме фазового равновесия мы можем отметить существование трех промежуточных фаз:
-устойчивой промежуточной фазы (конгруэнтно плавящейся) на основе химического соединения С2 с областью гомогенности η;
-инконгруэнтно плавящейся (неустойчивой) промежуточной
фазы на основе химического соединения С1 с областью гомогенности δ;
320

- инконгруэнтно плавящимся (неустойчивым) химическим соединением С3, который при нагреве в точке n распадается на жидкость состава точки о и η-твердый раствор состава точки m, т.е. происходит реакция обратная перитектической.
На рис. 5.49 приведена еще одна диаграмма фазового равновесия, в которой приведены все возможные реакции на горизонтальной линии (кроме метатектической реакции, которая была приведена на рис. 5.48).
Рис. 5.49. Гипотетическая диаграмма 2 фазового равновесия
Из рассмотрения этой диаграммы следует, что на горизонтальных линиях всегда должны присутствовать три фазы, что между однофазными областями всегда должны находиться двухфазные области. Область ограниченного α-твердого раствора может иметь линии солидуса и ликвидуса с минимумом на кривых плавления. На диаграмме показана γ-фаза, которая существует в определенном интервале температур выше комнатной; в частности, только при наличии этой фазы можно иметь по три фазы на линиях синтектической и эвтектоидной реакций. Промежуточная δ-фаза устойчива только при невысоких температурах и распадается по реакции, обратной перитектоидной.
321
Некоторая практика в построении воображаемых диаграмм фазового равновесия достаточно полезна для развития навыков анализа диаграмм. Этот навык незаменим при истолковании диаграмм, взятых из справочников и других литературных источников, поскольку в ряде случаев приходится сталкиваться с принципиально невозможными диаграммами, построенными по недостаточно проверенным экспериментальным данным. Наиболее часто распространены ошибки построения диаграмм, связанные с тем, что трехфазные равновесия не изотермичны, что на горизонтальных линиях можно обнаружить четыре (или две фазы) – это несовместимо с правилом фаз. Нередко можно увидеть, что какая-либо фаза касается горизонтальной линии не в одной точке, а в некотором интервале концентраций, что также несовместимо с правилом фаз. Пользователь всегда сможет обнаружить эти ошибки, если он знаком с принципами построения диаграмм фазового равновесия.
5.5. Фазовые равновесия в трехкомпонентных системах
Системы, составленные тремя компонентами, обычно называют тройными системами. Поскольку многие коммерческие сплавы основываются, по крайней мере, на трех компонентах, знание тройных диаграмм фазового равновесия имеет важное практическое значение. Принципы, заложенные в построение двухкомпонентных диаграмм фазового равновесия, достаточно просто распространяются на системы с тремя и более компонентов. Тройные диаграммы обычно строятся таким образом, что состав наносится на горизонтальной плоскости, а температура – по вертикали при постоянном давлении.
Простейший способ изображения тройного состава – равносторонний треугольник. На равностороннем треугольнике (его часто называют треугольником Гиббса) три чистых компонента находятся в углах треугольника А, В и С (рис. 5.50).
Двойные составы откладываются на сторонах треугольника (двойные системы АВ, ВС и АС). Составы тройных сплавов изображаются внутри треугольника, например, точкой Х. Треугольник
322
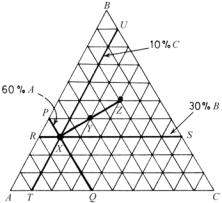
обычно разделяется равноотстоящими линиями, параллельными сторонам треугольника, на части, соответствующие 10 % (или 1 %) атомных или массовых процентов. Все точки, принадлежащие линиям, параллельным стороне ВС, имеют постоянное содержание компонента А; линии, параллельные стороне АС, представляют постоянную концентрацию компонента В, а линии, параллельные стороне АВ, постоянную концентрацию компонента С. Например, сплавы на линии PQ содержат 60 % А, сплавы на линии RS содержат 30 % В, а сплавы на линии TU содержат 10 % C. Поскольку сумма этих величин равна стороне треугольника Гиббса, то вместе они составляют 100 %, а в мольных долях ХА + ХВ + ХС = 1.
Рис. 5.50. Представление состава сплавов в тройной системе на концентрационном треугольнике (треугольнике Гиббса)
Можно показать, что если два сплава в трехкомпонентной системе смешиваются, то состав смеси будет лежать на отрезке прямой, соединяющей два исходных состава. Это правило наблюдается независимо от пропорции двух сплавов в смеси. И наоборот, если сплав распадается на две части различного состава, то состав этих двух частей будет лежать на концах отрезка, проходящего через точку исходного состава (см. составы X, Y и Z на рис. 5.50).
Очевидно, что линия XZ обладает свойствами коноды; она одновременно является и изобарой, и изотермой, поскольку лежит в плоскости составов, которая проводится перпендикулярно оси температур и соответствует случаю постоянного давления. Эту линию можно использовать в качестве рычага для правила отрезков.
323
Фазовые равновесия в тройных системах подчиняются правилу фаз, согласно которому в тройных системах число степеней свободы при реализации тех же равновесий, что и в двойных системах, увеличивается на единицу. Например, число степеней свободы при трехфазных равновесиях в двойных системах равняется нулю (нонвариантное равновесие), а в тройных системах – единице (моновариантное равновесие). Таким образом, в соответствии с принципом соответствия в тройных системах мерность геометрических образов, изображающих фазовые равновесия, увеличивается на единицу по сравнению с двойными. Поэтому точки, характеризующие составы фаз, участвующих в нонвариантных равновесиях (эвтектические, перитектические, эвтектоидные и др.), переходят в линии, на которых лежат составы фаз, участвующих в моновариантных превращениях. Линии ликвидуса, солидуса и ограниченной растворимости переходят в поверхности ликвидуса, солидуса и растворимости и т.д. Касательные к кривым свободной энергии Гиббса в плоскости G–x в двойных системах трансформируются в тройных системах в касательные плоскости к поверхностям свободной энергии
ит.п.
Вдвойных системах составы фаз, в частности твердой и жидкой, при кристаллизации меняются с температурой по кривым ликвидуса и солидуса. И все составы фаз, находящихся в равновесии, при каждой данной температуре лежат на соответствующих конодах, при этом коноды всегда находятся в той же вертикальной плоскости, в которой лежит вся двойная диаграмма. В тройной системе составы равновесных фаз изменяются с температурой по поверхностям ликвидуса и солидуса. При этом коноды для равновесных фаз одного и того же сплава, но для разных температур уже, как правило, не лежат в одной вертикальной плоскости. Появляется понятие конодного треугольника, о котором будет говориться далее.
Втех случаях, когда практическое использование объемной трехмерной тройной диаграммы бывает затруднено (чаще всего так
ибывает), пользуются сечениями тройных диаграмм горизонтальными и вертикальными плоскостями, которые называют соответственно изотермическими и политермическими (вертикальными) разрезами.
324

Свободная энергия Гиббса любой фазы может быть представлена на определенной вертикальной дистанции от определенной точки на треугольнике Гиббса. Если это сделано для всех составов, точки образуют поверхности свободных энергий для всех возможных фаз, как это показано на рис. 5.51. Значения химических потенциалов компонентов А, В и С в каждой фазе могут быть получены в точках пересечения осей А, В и С касательными плоскостями к поверхностям свободной энергии.
Рис. 5.51. Поверхности свободных |
Рис. 5.52. Проведение касательной |
плоскости к поверхностям свободных |
|
энергий жидкой и трех твердых фаз |
энергий α- и L-фаз для определения |
в тройной системе |
равновесного состав фаз |
Далее будет рассмотрена тройная система, в которой три двойные системы АВ, ВС и АС представляют собой простые эвтектики c ограниченной взаимной растворимостью компонентов в твердом состоянии. На рис. 5.51 представлены поверхности свободной энергии трех твердых фаз α, β и γ и жидкой фазы L. При данной температуре жидкая фаза является наиболее стабильной для всех составов сплавов. При понижении температуры поверхность GL движется вверх и со временем пересечет поверхность Gα, как это показано на рис. 5.52.
Сплавы с составами вблизи этого пересечения состоят из фаз α + L в состоянии равновесия. Для того, чтобы химические потен-
325
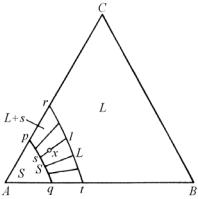
циалы были равны в обеих фазах, необходимо, чтобы составы двух фаз в равновесии определялись точками, например s и l, объединенными общей касательной плоскостью (см. рис. 5.52). Эти точки могут быть отмечены на изотермическом сечении диаграммы фазового равновесия, как это показано на рис. 5.53.
Линии, соединяющие составы фаз, находящихся в равновесии, как известно, называются конодами. Вращая касательную плоскость над двумя поверхностями свободных энергий, можно получить серию конод, таких, как pr и qt, и таким образом обозначить область pqtr, покрытую этими конодами, как двухфазную область фазовой диаграммы. Например, сплав состава х будет состоять из твердой α-фазы состава s и жидкой фазы L состава l (рис. 5.53). Относительные количества α-фазы и жидкой фазы L легко определяются по правилу отрезков. При данной температуре сплавы с составами внутри области Аpq будут представлять собой однородную α-фазу, а сплавы с составами внутри области BCrt будут полностью в жидком состоянии. Это соответствует также изотермическому сечению, показанному на рис. 5.54,a.
При дальнейшем охлаждении поверхность свободной энергии жидкой фазы будет подниматься, пересекая поверхности свободных энергий других фаз, создавая тем самым серию изотермических сечений, показанных на рис. 5.54. Например, на изотермическом сечении, представленном на рис. 5.54, д жидкая фаза стабильна в центральной области диаграммы, а α-, β- и γ-твердые фазы стабильны вблизи углов треугольника. Между ними находится
несколько двухфазных областей, содержащих пучки конод. Кроме этого, на изотермическом сечении показаны трехфазные области, часто называемые конодными треугольниками. Например, возни-
326
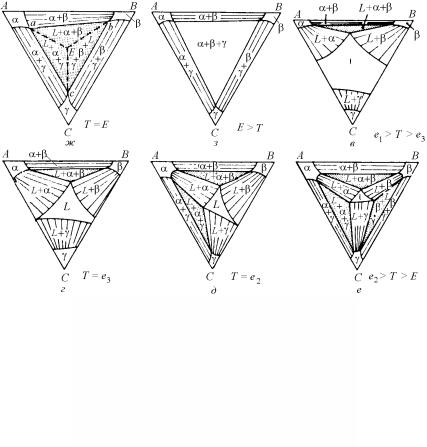
кает треугольник L + α + β, поскольку общая касательная плоскость одновременно касается Gα, Gβ и GL поверхностей. Поэтому любой сплав, имеющий состав внутри треугольника L + α + β, при этой температуре будет в равновесии как трехфазная смесь с твердыми растворами, находящимися в углах треугольника.
Рис. 5.54. Изотермические сечения тройной диаграммы фазового равновесия, представленной на рис. 5.55
Если происходит дальнейшее понижение температуры, область существования жидкой фазы сжимается до размера точки, и появляется плоскость, в которой четыре фазы L + α + β + γ находятся в
327
равновесии. Эту точку и плоскость называют соответственно точкой и плоскостью тройной эвтектики, а соответствующую температуру – температурой тройной эвтектики (рис. 5.54,ж). Ниже этой температуры жидкая фаза перестает быть стабильной и на изотермическом сечении присутствуют три двухфазных области и один трехфазный конодный треугольник, как это показано на рис. 5.54,з, т.е. при температурах ниже температуры тройной эвтектики существуют только твердые фазы.
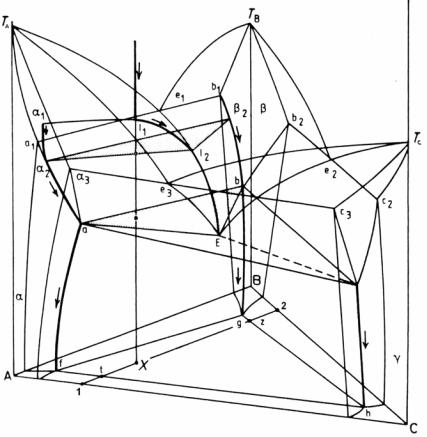
Рис. 5.55. Пространственная тройная диаграмма фазового равновесия, образованная тремя двухкомпонентными системами с простыми эвтектиками и ограниченной взаимной растворимостью компонентов в твердом состоянии
328
Поскольку при понижении температуры взаимная растворимость компонентов в твердом состоянии падает, при более низкой температуре (рис. 5.54,з) область α + β + γ увеличивается, а однофазные области становятся меньше, чем при более высокой температуре (рис. 5.54,ж). Если изотермические сечения построить для всех необходимых температур, то на их основе строится объемная трехмерная тройная фазовая диаграмма (рис. 5.55).
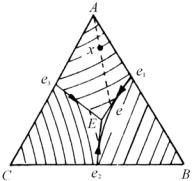
Для того чтобы рассмотреть процесс кристаллизации тройных сплавов (подразумевая, что равновесие соблюдается при всех температурах), полезно построить профиль поверхности ликвидуса (рис. 5.56) для тройной системы с тремя простыми двойными эвтектиками e1, e2 и e3. Точка E – это точка тройной эвтектики. В процессе равновесного охлаждения сплава состава х состав жидкости перемещается вдоль линии хе (проведенной через точки А и х) в то время, как α-фаза (кристаллы А) кристаллизуется на начальной стадии. Потом состав жидкости перемещается вдоль эвтектической впадины–линии двойной эвтектики eE (см. также рис. 5.55), при этом одновременно кристаллизуются α- и β-фазы. Окончательно в точке E – точке тройной эвтектики жидкость превращается изотермически в эвтектическую смесь α+β+γ.
Рис. 5.56. Проекции поверхностей ликвидуса на концентрационный треугольник Гиббса для тройной диаграммы фазового равновесия, представленной на рис.5.55
Все эти процессы наглядно иллюстрируются на рис. 5.55. В соответствии с правилом отрезков легко рассчитываются относительные доли затвердевших α-фазы (кристаллов А), двойной и тройной эвтектик (см. рис. 5.56). Для упрощения расчетов мы берем кристаллы А, а не α-твердый раствор. В сплаве, состав которо-
329

го отвечает точке х, количество первичных кристаллов А и жидкости L определяется соотношениями : количество А = ех/Ае·100 %, количество L = Ах/Ае·100 %. Количество двойной и тройной эвтектики определяется из соотношения отрезков еЕ и ее1: количество двойной эвтектики равно еЕ/Ее1·(100 – А) % и количество тройной эвтектики равно ее1/Ее1·(100 – А) %.
Как уже отмечалось ранее в ряде случаев полезно построение вертикальных (политермических) сечений тройной фазовой диаграммы. На рис. 5.57 представлен такой вертикальный разрез, проведенный через точку Х параллельно стороне АВ (рис. 5.55). Можно видеть, что при охлаждении из жидкого состояния сплав состава Х проходит через L + α область, затем попадает в область L + α + β, затем заканчивается кристаллизация, вся жидкость исчезает и сплав попадает в область α + β + γ.
Рис. 5.57. Вертикальный (политермический) разрез через точку Х параллельно стороне АВ тройной системы, приведенной на рис. 5.55
Существенным ограничением при построении и использовании для практических целей вертикальных разрезов является тот факт, что такой разрез не совпадает с линиями конод в двухфазных областях. Таким образом, диаграмма вертикального разреза показывает только фазы, которые находятся в равновесии при различных температурах, но не их состав. Поэтому, несмотря на их внешнее сходство, вертикальные разрезы не могут использоваться как бинарные диаграммы фазового равновесия, за исключением случая, когда вертикальный разрез проводится через две конгруэнтно плавящихся промежуточных фазы. В этом случае мы получаем псев-
330

добинарную диаграмму фазового равновесия, где промежуточные фазы являются компонентами.
Изображения пространственной модели, подобные приведенной на рис. 5.55, удобны для обзора общего вида тройной диаграммы и позволяют составить о ней качественное представление, но не пригодны для количественных оценок. Поэтому изотермические сечения, подобные представленным на рис. 5.54, наиболее пригодный способ графического изображения тройных равновесий в двух измерениях. В этом случае различные элементы диаграммы имеют простейшую форму. Этот метод становится достаточно сложным, когда для описания диаграммы фазового равновесия приходится проводить много изотермических сечений. Однако только таким способом в ряде случаев можно получить количественные оценки процессов и положения границ в тройной системе при определенных температурах.
Рассмотрим типичное изотермическое сечение тройной системы для компонентов с неограниченной растворимостью в твердом состоянии. Пространственная модель этой системы показана на рис. 5.58,а.
Рис. 5.58. Тройная система |
|
с неограниченной растворимостью |
|
компонентов в жидком и твердом |
|
состояниях: |
|
а – объемная модель системы; |
|
б – проекция линий пересечения |
а |
плоскости T1 c поверхностями |
|
ликвидуса и солидуса |
|
на концентрационный |
|
треугольник |
|
(изотермический разрез) |
|
|
б |
331
