
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы

ГЛАВА 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
Введение
Диаграммы фазового равновесия, или диаграммы состояния (со-
стояний) сплавов в графической форме показывают фазовый состав сплавов в зависимости от температуры, давления и концентрации. Диаграммы фазового равновесия, как правило, показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии. Диаграммы фазового равновесия служат рабочим инструментом для материаловедов при определении направленности процессов, связанных с фазовыми превращениями, выборе режимов термической обработки материалов, оптимальных составов сплавов с заданными свойствами и т.д. Определяя роль диаграммы состояния, известный русский ученый Н.С. Курнаков отмечал, что все детали процесса химического взаимодействия, например, появление новых фаз и определенных соединений, образование жидких и твердых растворов, находят точное и определенное отражение в том геометрическом комплексе поверхностей, линий и точек, который образует химическую диаграмму.
В соответствии с выбором температуры, давления и концентрации как основных параметров состояния системы, свободная энергия Гиббса оказывается основной термодинамической функцией, ее характеризующей (см. п. 4.1).
Графическое толкование изменения характеристических термодинамических функций в зависимости от параметров состояния и установление на этой основе закономерных графических соотношений между ними лежит в основе учения о диаграммах фазового равновесия. Таким образом, диаграммой фазового равновесия, или диаграммой состояния, называется графическое изображение соотношений между параметрами состояния. Каждая точка на диаграмме состояния, именуемая фигуративной точкой, определяет численные значения параметров, характеризующих данное состояние системы.
227
Напомним основные определения системы, компонентов, фазы, числа степеней свободы, структуры сплавов, структурных составляющих и правила фаз.
Система – группа тел (или веществ), которые выделяются из прочих тел (веществ) и в которых наблюдают интересующие нас превращения (или физико-химические взаимодействия).
Компоненты – это индивидуальные вещества, образующие данную систему. Химические соединения можно рассматривать как компоненты, если они не диссоциируют на составные части в исследуемых интервалах температур. Существует другое определение: число компонентов – это наименьшее число веществ, состав которых не может изменяться и которые образуют данную систему.
Фаза – это химически и физически однородная (гомогенная) часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
Под числом степеней свободы системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе.
Структура сплава – это реальное строение сплава: расположение, форма и размер зерен, а структурные составляющие – это те структурные элементы, из которых состоит структура. Структурные составляющие могут называться первичными, вторичными и т.д. Первичными структурными составляющими называются те, которые при охлаждении сплава выделяются из жидкой фазы. Вторичными и третичными называются структурные составляющие, которые при охлаждении сплава выделяются из твердых растворов.
Правило фаз – это термодинамическое выражение соотношения между числом фаз, числом компонентов, числом внешних переменных и числом степеней свободы для равновесной системы: С = К – Ф + 2, где С – число степеней свободы, К – число компонентов, Ф – число фаз. При постоянном значении давления правило фаз приобретает вид: С = К – Ф + 1.
Диаграмма фазового равновесия показывает, какие равновесные фазы существуют при данных условиях. Диаграмма показывает устойчивые состояния, т.е. состояния, которые при данных услови-
228
ях обладают минимумом свободной энергии. Поэтому диаграмма фазового равновесия может также называться диаграммой состояния (состояний) сплавов, так как она представляет собой графическое изображение состояния сплава.
5.1. Однокомпонентные диаграммы фазового равновесия, их построение и использование
внауке и технике
Всоответствии с выбором температуры, давления и концентрации как основных параметров состояния гетерогенной системы, мы однозначно приходим к выбору свободной энергии Гиббса в качестве основной термодинамической функции, ее характеризующей.
Воднокомпонентной системе уравнение состояния фазы в расчете на один моль имеет вид: dG = – SdT + VdP и свободная энергия Гиббса будет функцией только двух параметров состояния: температуры и давления:
G = f(T, p). |
(5.1). |
Таким образом, состояние системы будет описываться трехмерной G–p–T диаграммой.
В предположении, что равновесие двухфазное (например, рав-
новесие в точке плавления), имеем условие равновесия |
|
G(S) = G(L). |
(5.2) |
На основании равенства (5.1) получим |
|
GL = ϕ (T, p) GS =ϕ (T, p). |
(5.3) |
Решая совместно уравнения (5.3) с учетом выражения (5.2), най-
дем |
|
F (Τ, p) = 0. |
(5.4) |
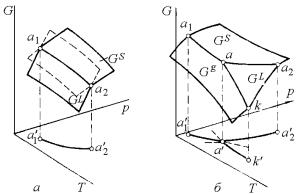
Уравнение (5.4) представляет цилиндрическую поверхность, на которой лежит кривая а1–а2 пересечения поверхностей G(L) и G(S) (рис. 5.1,а). При пересечении с плоскостью Т–p эта поверхность образует линию а'1–а'2, положение которой в системе координат G–
Τ–p определяется как |
|
F(Т, p) = 0; G = 0. |
(5.5) |
Положение той же линии в координатах Т–p можно представить уравнением
229
p = f (Т). |
(5.6) |
Следовательно, линия а'1–а'2 является одновременно графическим изображением уравнения (5.6) и проекцией линии пересечения поверхностей G(S) и G(L) на плоскость p–Т.
Для трех фаз однокомпонентной системы получаем (см. рис. 5.1,б) пересечение трех поверхностей для изобарных потенциалов соответственно жидкой, твердой и паровой фаз, следы которого проектируются на плоскость p–Т.
Риc. 5.1. Поверхность изобарно-изотермического потенциала однокомпонентной системы при равновесии твердой и жидкой фаз (a) и при возможных моновариантных равновесиях в однокомпонентной системе и трехфазном нонвариантном равновесии (б)
Таким образом, фазовая диаграмма передает связь между параметрами состояния (температурой и давлением) при одновременной связи их с изменением функции состояния, характеризующей фазы, образующие систему и их взаимные переходы. Областям существования фаз L, g и S на диаграмме, т. е. однофазным областям, отвечают соответствующие поверхности на диаграмме изобарноизотермического потенциала (рис. 5.1,б), линиям совместного существования попарно твердой и паровой gS, жидкой и паровой Lg, жидкой и твердой фаз LS отвечают линии пересечения поверхностей GS и Gg, GL и Gg, GL и GS соответственно. Точке совместного существования трех фаз L, S и g (иначе тройной точке) отвечает общая точка трех поверхностей GS, GL и Gg на рис. 5.1,б, для которой
GS = GL = Gg. |
(5.7) |
230

Если теперь представить отдельно результат указанного построения (рис. 5.2), то полученная диаграмма, которую собственно и называют диаграммой фазового равновесия, будет характеризовать фазовые взаимоотношения в однокомпонентной системе при различных значениях параметров состояния.
Рассмотрим более подробно зависимость изобарно-изотермического потен-
циала от двух параметров состояния (приняв остальные постоянными) при переходе от пространственной диаграммы к плоской фазовой диаграмме в координатах p–Τ.
Известно, что при рассмотрении зависимости G = f (Τ) в момент плавления кривые GL = f (Τ) и GS = f (T) должны пересекаться (рис. 5.3).
Рис. 5.3. Относительное расположение кривых температурной зависимости изобарно-изотермического потенциала твердой и жидкой фаз для однокомпонентной системы
Проиллюстрируем фиксирование температур двух- и трехфазного равновесий с помощью кривых температурной зависимости изобарно-изотермического потенциала. На рис. 5.4,а приведена диаграмма однокомпонентной системы. В соответствии с условием равновесия в тройной точке, описываемой выражением (5.7) при учете относительной стабильности фаз в конкретных температурных диапазонах для давления p*, отвечающего равновесному давлению сосуществования трех фаз, получим картину, показанную на рис. 5.4,б. Для давлений pI и рII соответственно ниже и выше р* относительное расположение кривых температурной зависимости изобарно-изотермического потенциала фаз S, L и g показано на рис. 5.4,в и г.
231
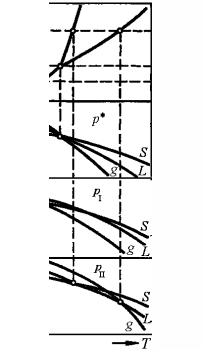
Рис. 5.4. Определение фиксированного положения температур двух- и трехфазного равновесий в однокомпонентной системе:
а – диаграмма однокомпонентной системы; б, в и г – относительное расположение кривых температурной зависимости изобарно-изотермического потенциала для различных фиксированных значений давления
Согласно условиям моновариантных равновесий S ' g, S ' L и L'g кривые изобарно-изотермического потенциала пересекаются одна с другой при температурах, отвечающих температурам фазовых переходов при давлениях pI и рII соответственно. Такая картина вытекает из рассмотрения трехмерной зависимости изобарноизотермического потенциала от параметров состояния и подчеркивает органическую взаимосвязь диаграммы состояния с диаграммой изобарно-изотермического потенциала. Целесообразно более подробно остановиться на однокомпонентных p–Т диаграммах, поскольку они имеют существенное прикладное значение.
Что характерно для p–Т диаграммы (рис. 5.2)? Это наличие:
-трех областей существования одной фазы S, g, L;
-линий существования двух фаз SL, Lg, Sg;
-тройной точки О;
-критической точки k.
Применим правило фаз Гиббса (С = К – Ф + 2) к p–Т диаграмме.
232

Для любой из областей S, g или L С = 1 – 1 + 2 = 2, т.е. можно изменять значения р и Т и оставаться в той же области существования одной фазы.
Рассмотрим линии SL, Lg или Sg. Для них С = 1– 2 + 2 = 1, т.е. можно изменять или p или Т. Один параметр всегда зависим от другого. Это моновариантные линии двухфазного равновесия.
В тройной точке О С = 1 – 3 + 2 = 0, т.е. нельзя сохранить 3 фа-
зы, меняя какой-либо параметр. Это нонвариантное равновесие.
С повышением температуры отличие молярных объемов жидкости и пара убывает с ростом давления. Критическая точка К соответствует таким температуре и давлению, при которых молярные объемы жидкости и пара, находящиеся в равновесии, становятся одинаковыми. Критическая температура Ткр, критическое давление pкр, критический объем Vкр являются физическими константами вещества.
Моновариантные (число степеней свободы равно 1) двухфазные равновесия S + g (сублимация), S + L (плавление), L + g (испарение) чистого компонента представлены линиями сублимации Sg, плавления SL, испарения L. Они описываются уравнением Клайпе- рона–Клаузиуса
|
|
dp |
|
= |
S |
|
; |
(5.8) |
|||
|
|
dT |
|
V |
|||||||
|
|
|
|
|
|
|
|
||||
при G = 0 H = T S |
|
|
|
|
|
|
|
|
|||
|
dp |
|
= |
|
H |
. |
(5.9) |
||||
|
dT |
|
|
||||||||
|
|
|
T V |
|
|
|
|||||
Наклон двухфазных линий Sg, SL и Lg, т.е. знак и величина производной в выражениях (5.8) и (5.9) определяется соотношением
объемов равновесных фаз, поскольку энтропии и теплоты сублимации (SSg, HSg),плавления (SSL, HSL) и испарения (SLg, HLg) положи-
тельны.
Линия сублимации (или возгонки) Sg имеет положительный на-
клон ddTp > 0, так как мольный объем пара значительно превосходит
мольный объем твердой фазы. Линия сублимации заканчивается в нонвариантной точке О.
233
Линия испарения Lg начинается в нонвариантной точке О и заканчивается в критической точке K, где фазы L и g оказываются
идентичными. Наклон линии Lg также положителен, поскольку
HLg > 0 и VLg > 0.
Мольную теплоту сублимации HSg можно представить как сумму теплот плавления HSL и испарения LLg. Изменения объемов при испарении и сублимации примерно одинаковы. Таким образом, угловой коэффициент линии сублимации больше, чем угловой коэффициент линии испарения
dp Sg |
dp Lg |
|
|||||
|
|
|
> |
|
|
, |
(5.10) |
|
|
||||||
dT |
dT |
|
|
||||
т.е. при сопоставимых температурах кривые возгонки идут круче, чем кривые испарения.
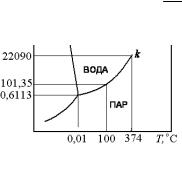
Линия плавления SL начинается в нонвариантной точке О. Так как существует различие свойств твердой и жидкой фаз, то критическая точка кривой плавления SL неизвестна. В соответствии с уравнением (5.8) линии SL описывают зависимость температуры плавления от давления. Перевод вещества из твердого в жидкое состояние требует затраты теплоты HSL и SSL > 0. Поэтому характер зависимости температуры плавления от давления определяется соотношением мольных объемов VSL = VL – VS. Для подавляющего большинства веществ такой переход сопровождается увеличением
объема VSL >0 и поэтому ddTp > 0, и с увеличением давления темпе-
ратура плавления повышается.
|
В некоторых случаях: германий, |
|||
|
||||
|
кремний, вода, галлий, висмут моль- |
|||
|
ный объем жидкой фазы меньше, |
|||
|
чем твердой: VSL =VL – VS < 0. В соот- |
|||
|
ветствии с уравнением (5.9) |
|
dp |
< 0, |
|
|
|
||
|
|
|
dT |
|
|
и с повышением давления темпера- |
|||
|
тура плавления таких |
веществ |
||
|
уменьшается. На рис. 5.5 приведена |
|||
Рис. 5.5. Диаграмма p-Т для воды |
||||
|
p–T диаграмма для воды. |
|
|
|
234
Поскольку изменение объема при превращении конденсированных фаз существенно меньше, чем при сублимации или испарении, то угловой коэффициент линий Sg и Lg:
dp Sl |
dp Sg |
dp Lg |
|
||||||
|
|
|
≥ |
|
|
> |
|
. |
(5.11) |
|
|
|
|||||||
dT |
dT |
dT |
|
||||||
Моновариантные линии двухфазного равновесия SL, Sg и Lg пересекаются в тройной точке, где в равновесии существуют три фа-
зы: S + L + g.
Продолжения моновариантных кривых за тройную точку соответствуют метастабильным равновесиям и показаны на рис. 5.2 пунктиром. Линия аО определяет давление пара над переохлажденной жидкостью, линия Од – давление пара над перегретой твердой фазой, линия Об соответствует переохлажденной смеси жидкость + твердая фаза. Изобарно-изотермический потенциал таких систем больше равновесного значения, что приводит к самостоятельному исчезновению метастабильной фазы. Например, давление пара над переохлажденной жидкостью больше давления пара над твердой фазой, поэтому превращение жидкость в твердую фазу происходит самопроизвольно.
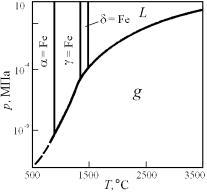
Если твердое вещество имеет несколько модификаций, т.е. существует в виде нескольких стабильных форм с различной кристаллической структурой (это называется аллотропией или полиморфизмом), то на p–Т диаграмме появляются дополнительные моновариантные линии и нонвариантные точки, но общее строение p–Т диаграммы
не изменяется (рис. 5.6). Рис. 5.6. Диаграмма p-Т для железа
Диаграммы p–Т широко используются в науке и производстве, в частности, на знании особенностей диаграммы p–Т для гексафторида урана UF6 основано газодиффузионное разделение изотопов урана-235 и урана-238 (рис. 5.7). При относительно невысокой температуре гексафторид урана UF6 переводится в газообразное
235
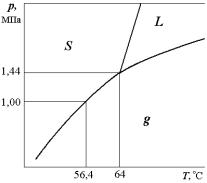
состояние и уже в этом состоянии проводится разделение изотопов урана.
Рис. 5.7. Диаграмма p-Т для гексафторида урана UF6
5.2. Двухкомпонентные диаграммы фазового равновесия
5.2.1. Диаграмма с полной взаимной растворимостью компонентов в жидком и твердом состояниях
В главе 4 приведены общие принципы геометрической термодинамики при построении диаграмм фазового равновесия. Установлен общий характер концентрационной зависимости свободной энергии Гиббса. Эта зависимость в сочетании с температурной зависимостью G позволяет прогнозировать возможные варианты характера фазового равновесия в двухкомпонентных системах.
Проведя общую касательную к кривым концентрационной зависимости изобарно-изотермического потенциала, можно установить составы фаз, находящихся в равновесии. Рассмотрим двухкомпонентную систему А–B, в которой при некоторой температуре T1 в равновесии находятся жидкая L и твердая S фазы. Очевидно, каждая из фаз характеризуется собственной кривой зависимости свободной энергии Гиббса от состава (рис. 5.8).
Условием проведения общей касательной к двум кривым является, во-первых, равенство угловых коэффициентов в точках касания, а во-вторых, принадлежность точек касания одной и той же
236
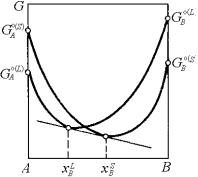
прямой. Учитывая характер рассматриваемой фундаментальной зависимости, первое условие можно записать в виде
(дG/дxB)Lp,T = (дG/дxB)Sp,T . |
(5.12) |
Рис. 5.8. Проведение общей касательной к кривым концентрационной зависимости изобарно-изотермических потенциалов твердой и жидкой фаз
Это условие является необходимым, но не достаточным, так как касательные к двум кривым могут иметь одинаковый наклон на разных уровнях, т. е. точки касания могут не принадлежать одной и той же прямой. Поэтому помимо равенства угловых коэффициентов необходимо записать условие принадлежности точек касания к одной и той же прямой. Таким условием является равенство химических потенциалов (см. п. 4.2.4):
μLA = μSA ; μBL = μSB . |
(5.13) |
В выражениях (5.12) и (5.13) отражено выполнение условий равновесия твердой и жидкой фаз при данных температуре и давлении. Следовательно, проведение общей касательной к кривым концентрационной зависимости свободной энергии Гиббса является геометрической интерпретацией условия фазового равновесия и позволяет однозначно фиксировать составы сосуществующих фаз (см. рис. 5.8). Установленное геометрическое условие равновесия широко используется на практике при установлении возможных видов равновесия в двухкомпонентных системах. Отрезок общей касательной, заключенный между концентрациями равновесных фаз, называется конодой, а ее проекция на плоскость температура– концентрация преобразуется в отрезок горизонтальной прямой (коноду), соединяющий составы фаз, находящихся в равновесии.
237
В конденсированных системах роль давления сравнительно невелика, и в известных пределах ею можно пренебречь. В этом случае для двухкомпонентных систем в качестве параметров состояния, определяющих характер фазовой диаграммы на плоскости, остаются температура и концентрация. Фиксируя один из этих параметров, получаем возможность установить четкую зависимость изобарно-изотермического потенциала от другого параметра.
Принцип установления характера фазового равновесия на основе температурной и концентрационной зависимостей изобарноизотермического потенциала сводится к установлению фиксированного положения фигуративных точек с координатами равновесно сосуществующих фаз на плоскости температура–концентрация.
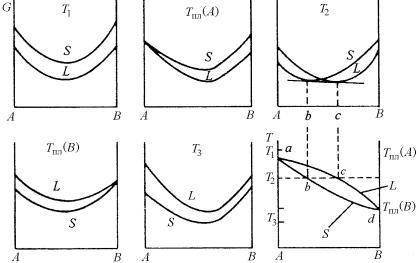
На рис. 5.9 представлены принципиальная схема построения диаграммы фазового равновесия из компонентов, неограниченно растворимых в жидком и твердом состояниях, и зависимость изо- барно-изотермического потенциала жидкой (L) и твердой (S) фаз от состава и температуры.
Рис. 5.9. Кривые изобарно-изотермического потенциала жидких и твердых растворов при температурах Т1 , Т2 , Т3 , Tпл (A), Tпл (B) и диаграмма фазового равновесия c неограниченной растворимостью компонентов в жидком
и твердом состояниях
238
Заранее известно, что система образована только двумя фазами. Кроме того, известны температуры плавления компонентов А и В. Полная растворимость в твердом состоянии возможна только при изоморфных компонентах (компонентах, имеющих одинаковую кристаллическую решетку). При высокой температуре Т1 все сплавы системы жидкие, и кривая G жидкой фазы лежит ниже кривой твердой фазы. При низких температурах (Т3 и ниже) кривая G жидкой фазы расположена выше, чем кривая твердой фазы. Это значит, что при низких температурах стабильна твердая фаза. При температурах плавления Tпл (A) и Tпл (B) компонентов А и В соответственно наблюдается пересечение кривых G твердой и жидкой фаз. Между температурами плавления А и В кривые жидкой и твердой фаз пересекаются, и при проведении к ним общей касательной можно найти составы жидкой и твердой фаз, находящихся в равновесии при той или иной температуре.
Кривую, соединяющую все точки типа с (рис. 5.9) и отвечающую температурам начала выделения твердой фазы из жидкой (кристаллизации) при охлаждении, принято называть кривой ликвидуса. Соответственно, кривую, объединяющую все точки типа b и отвечающую температурам конца процесса преобразования жидкой фазы в твердую (затвердевания) при охлаждении или началу выделения жидкой фазы из данной твердой (плавлению) при нагревании, называют кривой солидуса.
Если же говорить о конденсированных системах, то очевидно, что, помимо описанного вида равновесия между жидкой и твердой фазами, возможно существование равновесия между двумя жидкими или между двумя твердыми фазами в случае разрыва растворимости. Заметим, что путь установления фиксированного положения координат равновесных фаз на диаграмме Τ–x остается тем же самым, что и в случае равновесия между жидкой и твердой фазами.
На рис. 5.10 схематически показано, как фиксируются координаты равновесных фаз α1 и α2, которые могут быть соответственно жидкими или твердыми. При этом в связи с неустойчивостью однородного раствора в интервале концентраций xα1 – хα2 на кривой зависимости свободной энергии Гиббса от состава появляется максимум и одновременно два минимума. И в данном случае основной
239
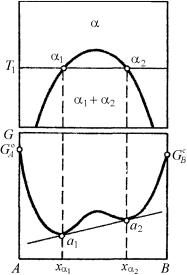
прием определения составов равновесных фаз при температуре T1 сводится к проведению общей касательной к кривой концентрационной зависимости изобарно-изотермического потенциала. Это графическое выполнение условия термодинамического равновесия гетерогенной системы в форме равенства химических потенциалов данного компонента в каждой из сосуществующих фаз.
Таким образом, рассмотрены основные виды двухфазных равновесий в гетерогенной конденсированной системе. Если рассматривать варианты фазовых равновесий, которые можно термодинамически сконструировать в двухкомпонентной системе, то их в принципе может быть достаточно много, особенно при условии, что один или оба компонента имеют по несколько полиморфных превращений.
Рассмотрим конкретно процессы, происходящие в двухкомпонентной диаграмме фазового равновесия с полной взаимной растворимостью компонентов в жидком и твердом состояниях (или с образованием непрерывного ряда твердых растворов).
Твердые растворы замещения с неограниченной растворимостью в твердом состоянии (изоморфные твердые растворы) могут обра-
зовываться при следующих условиях:
-компоненты А и В должны обладать одинаковыми по типу (т.е. изоморфными) кристаллическими решетками;
-различие в атомных размерах компонентов не должно превы-
шать 14 –15 %;
-компоненты должны принадлежать к одной и той же группе Периодической системы элементов или к смежным родственным
240
группам и в связи с этим иметь близкое строение валентной оболочки электронов в атомах.
Необходимо отметить возможность образования непрерывных твердых растворов не только элементами, но и химическими соединениями, например, карбидами ZrC и UC.
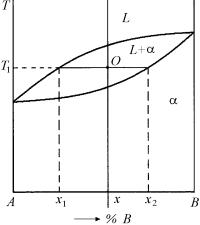
Диаграмма фазового равновесия дает возможность установить не только состав равновесных между собой фаз, но и их количества. Для этого используется правило отрезков (или рычага), которое мы рассмотрим на примере диаграммы фазового равновесия с образованием непрерывного ряда твердых растворов (рис. 5.11).
Допустим, что имеется при температуре T1 сплав состава х из двух фаз: жидкой L и твердой α. Составы отдельных фаз и средний состав сплава даны концентрациями компонента В, а именно: х – среднее концентрация в % компонента В в сплаве, состоящем из жидкой и твердой фаз, х1 – концентрация в % компонента В в жидкой фазе, х2 – концентрация в % компонента В в твердой фазе. Точка О – фигуративная точка, ее положение точно известно.
Сумма весовых количеств обеих фаз равна единице, т.е.
p + q = 1. |
(5.14) |
Из. рис. 5.11 следует, |
что ко- |
личество компонента В в системе может быть определено уравнением:
pх1 + qх2 = x. |
(5.15) |
Решая уравнения |
(5.14) и |
(5.15), получаем:
p = (х2 – x) / ( х2 – х1), q = (x – х1) / (х2 – х1).
Разделив первое равенство на второе, получаем:
p / q = (х2 – x) / (x – х1).
Эти выражения представляют собой правило рычага или отрезков.
Значения для p и q даны для случая, когда общий вес сплава
Рис. 5.11. Диаграмма фазового равновесия с образованием непрерывного ряда твердых и жидких растворов
(к выводу правила отрезков)
241
равен единице. Если весовое количество сплава равно Q, то для определения количества p и q нужно выражение для p и q умножить на это количество.
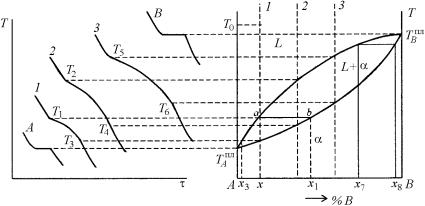
Рассмотрим процессы, происходящие в любом сплаве заданной системы при охлаждении (рис. 5.12), например, в сплаве 1.
В интервале температур от T0 до T1 происходит охлаждение сплава в жидком состоянии. При температуре T1 начинается процесс кристаллизации с выделением первых кристаллов твердой фазы α состава х1. Проведем коноду ab и тогда состав твердой фазы определится точкой b, а жидкой – a, точнее их проекциями (х1 и x) на ось концентраций. При понижении температуры от T1 до T3 будет происходить кристаллизация сплава с выделением кристаллов твердой фазы α, состав которой будет изменяться по линии солидус с изменением концентрации от х1 до x. При этом состав жидкой фазы L будет изменяться по линии ликвидус с изменением концентрации от x до х3. При температуре T3 заканчивается затвердевание сплава. Интервал температур от T1 до T3, т.е. между кривыми ликвидус и солидус, называется интервалом кристаллизации. Следует отметить, что при охлаждении происходит полное затвердевание сплава в тот момент, когда составы твердой фазы и среднего состава сплава совпадут. От температуры T3 до комнатной температуры происходит охлаждение твердого сплава.
Рис. 5.12. Диаграмма фазового равновесия с образованием непрерывного ряда твердых и жидких растворов и кривые охлаждения
242
Состав выделяющихся кристаллов твердого раствора по сравнению с составом жидкой фазы всегда богаче компонентом, повышающим температуру затвердевания данного сплава. Таким образом, выделяющиеся кристаллы твердого раствора имеют переменный состав, зависящий от температуры. Однако, при медленном охлаждении процессы диффузии в жидкой и твердой фазах (объемная диффузия), а также процессы взаимной диффузии между ними (межфазная диффузия) успевают за процессом кристаллизации, поэтому состав кристаллов выравнивается. Если кристаллизация идет быстрее, чем протекают процессы диффузии, наблюдается образование неоднородных по химическому составу кристаллов, т.е. происходит внутрикристаллическая ликвация. Для того чтобы выровнить состав, проводят термическую обработку, которая называется гомогенизирующий (диффузионный) отжиг. Для этой цели сплав нагревают несколько ниже кривой солидуса и выдерживают при этой температуре в течение определенного промежутка времени.
На рис. 5.12 также приведены типичные кривые охлаждения сплавов и чистых компонентов для данной диаграммы фазового равновесия. На кривой охлаждения сплава состава х (в координатах температура – время охлаждения) наблюдаются две критические точки (перегибы), отвечающие температурам начала и конца его кристаллизации, а на кривых охлаждения компонентов А и В, соответственно, по одной критической точке в виде горизонтальной площадки (остановки) при температурах, отвечающих их температурам плавления.
Различия в кривых охлаждения сплава х и компонента А или В легко объясняются с помощью правила фаз. Согласно этому правилу равновесие жидкости и кристаллов при температуре плавления компонента А (или В) является нонвариантным (С = К – Ф + 1 = = 1 –2 + 1 = 0). Следовательно, оно возможно только при постоянной температуре. Поэтому на кривых охлаждения компонентов А и В температурам их кристаллизации отвечают горизонтальные остановки. Что касается равновесия жидкости и α-кристаллов при кристаллизации сплава х, то оно является моновариантным (С = К – Ф + + 1 = 2 – 2 + 1 = 1) и реализуется в некотором интервале темпера-
243
тур (т.е. в интервале кристаллизации). Поэтому на кривой охлаждения сплава х горизонтальная площадка отсутствует, а имеются два перегиба.
При моновариантном равновесии два параметра (температура и концентрация) системы взаимозависимы, т.е. принимая определенное значение состава твердой фазы х7, одновременно фиксируют строго определенные значения температуры T7 и состава жидкой фазы х8 и, наоборот, фиксируя определенное значение температуры получают строго определенные значения составов находящихся в равновесии твердой и жидкой фаз.
Рассмотрение фазовой диаграммы, типа приведенной на рис. 5.12, показывает, что добавление компонента В к компоненту А приводит к увеличению температуры плавления последнего, тогда как добавление А к В, наоборот, снижает его температуру плавления.
Однако, помимо рассмотренного случая, представляют интерес два других случая взаимного влияния компонентов при добавлении одного к другому на температуру плавления, а именно: температуры плавления снижаются или температуры плавления повышаются.
Вэтих случаях кривые ликвидуса и солидуса на соответствующей диаграмме состояния имеют общую точку: в первом случае – минимума, а во втором – максимума. Вид фазовых диаграмм этого типа показан на рис. 5.13,а и б.
Термодинамический вывод этих диаграмм с помощью кривых концентрационной зависимости изобарно-изотермического потенциала приведен на рис. 4.33.
Вточке минимума или максимума (рис. 5.13, а и б) кривые ликвидуса или солидуса касаются одна другой, и к ним можно провести одну общую горизонтальную касательную. Сплав, отвечающий по составу точке минимума или максимума, имеет нулевой интервал кристаллизации и одинаковые составы жидкости и кристаллов при температуре минимума или максимума. Таким образом при кристаллизации (или плавлении) он ведет себя как компонент А (или В) и имеет аналогичную кривую охлаждения.
Однако применение правила фаз Гиббса к равновесию жидкой и твердой фаз при температуре их минимума или максимума показывает, что это равновесие моновариантно (С= К– Ф+ 1 = 2 – 2 + 1 = 1).
244
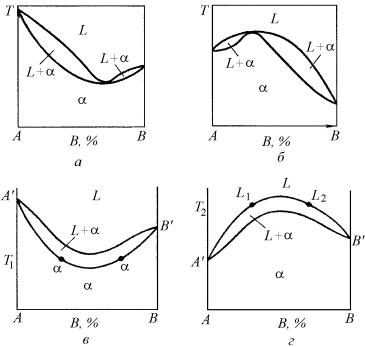
Рис. 5.13. Диаграммы фазового равновесия двухкомпонентной системы с непрерывным рядом твердых и жидких растворов при наличии общей точки
минимума (а) или максимума (б) на кривых ликвидуса и солидуса; неправильное построение диаграммы (в и г)
Дополнение к правилу фаз, сделанное Ван-дер-Ваальсом, объясняет это противоречие. В соответствии с этим дополнением любая двухфазная система независимо от числа образующих ее компонентов при идентичности составов равновесных фаз ведет себя как однокомпонентная. Поэтому для сплава, отвечающего по составу экстремальной точке, это является дополнительным условием, снижающим вариантность системы в данной точке на единицу. В точке максимума или минимума системы равновесие должно быть нонвариантным и сплавы, отвечающие составу экстремальных точек на рис. 5.13,а и б, ведут себя как однокомпонентные системы. Такой сплав плавится и затвердевает изотермически без изменения состава жидкой и твердой фаз. Эти сплавы можно рассматривать
245
как компоненты в двухкомпонентной системе, т.е. в данном конкретном случае диаграмму фазового равновесия можно разделить на две самостоятельные диаграммы.
Следует отметить, что кривые ликвидуса и солидуса обязательно должны касаться одна другой в экстремальной точке. В противном случае в некоторых сплавах в интервале кристаллизации в равновесии должны оказаться не жидкость и α-кристаллы, а две аналогичные фазы, например, две твердые (рис. 5.13,в) или две жидкие (рис. 5.13,г), что противоречит самому понятию интервала кристаллизации. По определению конода – это горизонтальная линия, соединяющая составы фаз, находящихся в равновесии. Если проводить коноды в интервале кристаллизации на рис. 5.13, б и г,
то получается абсурдная ситуация, так как при затвердевании или плавлении равновесными фазами оказываются твердая и твердая фазы или жидкая и жидкая фазы.
Целесообразно рассмотреть полную диаграмму фазового равновесия двухкомпонентной системы с изоморфными твердыми растворами, в которой были бы представлены все три фактора, могущие изменяться извне (давление, температура и состав). Для этой цели обратимся к трехмерной пространственной модели на рис. 5.14.
Это диаграмма p–Т–x (давление–температура–состав). Давление откладывается по вертикали, а температура и состав – по горизонтальным осям. Правая сторона диаграммы представляет компонент В и является p–Т-диаграммой для этого компонента. Аналогично левая сторона – p–Т-диаграмма для компонента А. В пространственной модели имеются три пары кривых поверхностей, которые соединяют соответственные кривые обоих компонентов. Одна из этих пар поверхностей, которая соединяет кривые сублимации компонентов А и В, пересекает переднюю стенку модели по двум кривым аАаВ, показывающим, что обе поверхности ограничивают пространство чечевицеобразного сечения, в котором сосуществуют твердая и газовая фазы. Другая такая пара bAbB, соединяющая кривые плавления, ограничивает пространство аналогичной формы, в котором сосуществуют жидкая и твердая фазы. Третья пара соединяет кривые испарения и ограничивает пространство сосуществования жидкой и газовой фаз. Между двухфазными областями за-
246

ключены три обширных области, представляющие собой стабильные состояния каждой из трех фаз системы. Это область газовой фазы (вдоль нижней плоскости диаграммы), твердой (спереди вверху) и жидкой фазы (сзади вверху). Следует обратить внимание на то, что однофазные области разделены двухфазными областями со всех сторон, кроме координатных плоскостей, ограничивающих диаграмму, где однофазные области разделены тройными кривыми для компонентов. Хотя пространственная диаграмма должна простираться вверх безгранично, диаграмма на рис. 5.14 произвольно ограничена горизонтальной (изобарной) плоскостью. Если эта плоскость отвечает давлению 1 атм, то соответствующее сечение представляет фазовое равновесие компонентов А и В при нормальном (атмосферном) давлении. Это будет обычная диаграмма фазового равновесия в координатах температура – состав, представленная на рис. 5.12.
Рис. 5.14. Трехмерная пространственная модель фазовой диаграммы с изоморфными растворами
247
