
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
Способность металла сопротивляться коррозионному воздействию среды называется коррозионной стойкостью. Химическая стойкость металлических материалов зависит не только от природы, состава и структуры самого материала, но также от состава технологической среды, гидродинамических условий эксплуатации изделий. Материалы, стойкие в одних условиях, оказываются совершенно нестойкими в других. Алюминий устойчив во влажном воздухе, но неустойчив в растворах NaCl; медь устойчива в разбавленной Н2SO4, но неустойчива в концентрированной; железо устойчиво в концентрированной НNO3, но неустойчиво в разбавленной.
Коррозионную стойкость определяют количественно скоростью коррозии в данных условиях, качественно – группой или баллом стойкости по принятой шкале (табл. 7.1).
7.1.3. Коррозионные проблемы
Металлические изделия и конструкции составляют наиболее значительную и ценную часть основных производственных фондов любой промышленно развитой страны; их защита от коррозионного разрушения является важной экономической проблемой. Потери от коррозии в странах мира составляют около десятой части национального дохода. Коррозия растет с увеличением металлического фонда государства и разрушает до трети всего производимого металла.
Различают прямые и косвенные коррозионные потери.
Под прямыми потерями понимают стоимость капитального и текущего ремонта преждевременно вышедших из строя из-за коррозии машин, оборудования и коммуникаций или их полной замены, а также дополнительные и эксплуатационные расходы на их защиту от коррозии. К прямым потерям относят и безвозвратные потери металла в виде продуктов коррозии и потери от истирания, которые достигают 10 % от начальной массы металла.
К косвенным потерям относят экономические затраты, связанные с отказом в работе и простоем металлического оборудования вследствие: загрязнения его продуктами коррозии (например, накопление ржавчины в трубопроводах); потерей продуктов (масла,
449
газа, воды и др.) через прокорродировавшую систему; загрязнением чистого продукта продуктами коррозии; допусками на коррозию при проектировании оборудования. Сюда же относятся и невосполнимые потери при авариях.
Для организации и проведения эффективной борьбы с коррозией необходимы фундаментальные коррозионные исследования, а также внедрение комплекса противокоррозионных мероприятий на стадии проектирования.
Экономический фактор является главной движущей силой большинства прикладных коррозионных исследований. Второй важный аспект исследований – повышение надежности оборудования, которое в результате коррозии может разрушаться с катастрофическими последствиями. Надежность – важнейшее условие при разработке оборудования АЭС и систем захоронения радиоактивных отходов. Третьим аспектом исследований является сохранность металлического фонда, мировые ресурсы которого ограничены. Не менее важно, что человеческий труд, затрачиваемый на проектирование и восстановление металлического оборудования, пострадавшего от коррозии и ее последствий, может быть направлен на решение других общественно полезных задач. Основой же дальнейшего прогресса в этой области должны стать фундаментальные исследования процессов коррозии.
7.1.4.Роль термодинамики и химической кинетики при исследовании процессов коррозии
Основной причиной коррозии металлов и сплавов является их термодинамическая неустойчивость в различных средах при данных внешних условиях. Степень термодинамической неустойчивости металла зависит как от свойств металла или сплава, так и от характера коррозионной среды и внешних условий. Количественно она может быть охарактеризована знаком и величиной изменения изобарного потенциала G при протекании соответствующей коррозионной реакции (см. п. 4.2).
Для определения направления реакции (например, окисления металла) рассматривают изменение энергии Гиббса G из-за ее
450
прохождения: G = G2 – G1, где G1 и G2 – энергия Гиббса исходных веществ и продуктов реакции соответственно.
Самопроизвольно протекают те процессы, которые сопровождаются уменьшением энергии Гиббса, т.е. для которых G1 > G2, или, что то же самое, G < 0. Для реакций окисления у всех металлов (кроме золота) при стандартных условиях (T = 298 K, р = 1 aтм) Gº < 0. Следовательно, металлы самопроизвольно переходят в окисленное состояние при взаимодействии с кислородом окружающей среды. При G > 0 реакция идет в сторону восстановления, т.е. оксид будет неустойчив. При G = 0 система находится в состоянии равновесия, движущая сила коррозии отсутствует. Тем самым термодинамика определяет возможность или невозможность самопроизвольного протекания коррозионного процесса при определенных условиях.
Скорость коррозии, как и любого другого процесса, можно оценить отношением величин движущей силы процесса и сопротивления (торможения) процесса. Значения термодинамических потенциалов металлов можно использовать для оценки движущей силы процесса, т.е., зная значения G, можно определить вероятность протекания коррозии, рассчитать условия, уменьшающие или полностью исключающие возможность ее протекания (применение защитных газовых атмосфер, обескислороживание воды, катодная защита). Информацию о скорости термодинамически возможного коррозионного процесса и о характере влияния различных внутренних и внешних факторов на итог процесса дают кинетические исследования.
Коррозионный процесс обычно протекает на границе раздела фаз при взаимодействии твердого вещества с газом или жидкостью. Такой гетерогенный процесс можно представить в виде следующих основных этапов:
а) транспортировка реагирующих веществ к поверхности раздела фаз;
б) химическое взаимодействие; в) отвод продуктов реакции из реакционной зоны.
Любой из указанных этапов может состоять из элементарных стадий, протекающих последовательно, параллельно или сопря-
451
женно. Скорость коррозии определяется либо скоростью самой медленной из последовательно протекающих стадий, либо скоростью самой быстрой из параллельных стадий. Установление лимитирующей (определяющей) стадии процесса – ключевой вопрос кинетики коррозионных процессов. Зная определяющую скорость процесса стадию, можно воздействовать на ее ход, замедлив (или остановив) коррозионное разрушение.
7.1.5. Классификация процессов коррозии
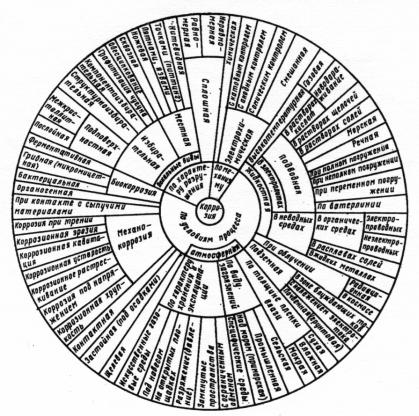
Процессы коррозии удобно рассматривать в соответствии с принятой классификацией, пример которой представлен на рис. 7.2.
Рис. 7.2. Схема классификации процессов коррозии
452
Чаще всего коррозионные процессы классифицируют по: а) механизму реакций взаимодействия материала со средой; б) виду и природе коррозионной среды;
в) виду (геометрическому характеру) коррозионных разрушений на поверхности или в объеме металла;
г) характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
Кроме предложенной классификации, коррозию можно рассматривать с учетом специфики использования машин, оборудования и сооружений в промышленности, сельском хозяйстве и на транспорте. По механизму реакций взаимодействия металла со средой различают два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия – взаимодействие металла с окислительным компонентом коррозионной среды, при котором окисление металла и восстановление окислительного компонента среды происходит в одном акте, например: 4Fe + 3O2 = 2Fe2O3, т.е. атомы металла непосредственно соединяются химической связью с окислителем, отнимающим валентные электроны металла, образуя продукт коррозии. Химическая коррозия подчиняется законам чисто химических гетерогенных реакций и не сопровождается возникновением электрического тока.
Электрохимическая коррозия металла протекает в присутствии электролитически проводящей среды. При этом ионизация металла и восстановление окислительного компонента среды протекают не в одном акте и зависят от потенциала металла. Окислительный компонент при этом не входит в состав продукта коррозии, например: Fe + 2H2O = Fe(OH)2 + 2H+ + 2e–. Электрохимическая коррозия подчиняется законам электрохимической кинетики и сопровождается протеканием электрического тока.
Коррозию, протекающую под влиянием жизнедеятельности микроорганизмов (бактерий, грибков), относят к биологической коррозии, которая может протекать по химическому, электрохимическому или смешанному механизму, а протекающую под действием радиоактивного излучения – к радиационной.
453
По виду и составу коррозионной среды, участвующей в процес-
се разрушения металлов и сплавов, различают:
газовую коррозию – химическое взаимодействие металлов с активными компонентами газовой среды (сернистым газом, сероводородом, кислородом, галоидами, углекислотой, водяным паром и др.) при повышенной температуре (например, коррозия реактивных сопел под действием газовых продуктов горения топлива);
атмосферную коррозию, при которой электрохимические процессы идут в тонкой пленке влаги, осаждающейся на металле из атмосферного воздуха;
коррозию в жидкостях:
а) неводных средах (жидких металлах, расплавах солей), б) неэлектролитах (органических растворителях, жидком топли-
ве, броме), в) в электролитах (растворах солей, кислот, щелочей, морской и
речной воде); подземную коррозию – коррозию металлов в почвах и грунтах
(например, ржавление подземных металлических трубопроводов); коррозию блуждающим током – электрохимическую коррозию металла под воздействием блуждающего тока (например, плохое заземление электрических машин, выпрямителей и т.п. приводит к утечкам тока через металлические конструкции и другие токопроводящие пути и вызывает коррозию электрически соединенных
конструкций и оборудования).
По характеру изменения поверхности металла или его физико-
механических свойств в процессе коррозии независимо от свойств среды коррозию подразделяют на общую, местную и избиратель-
ную.
Если коррозией охвачена вся поверхность металла, то такой вид разрушения называют общей, или сплошной, коррозией, например под действием кислот, щелочей, атмосферы. Сплошная коррозия может быть равномерной (рис. 7.3,а), т.е. разрушение металла происходит с одинаковой скоростью по всей поверхности, и неравномерной (рис. 7.3,б), когда скорость коррозии на отдельных участках поверхности неодинакова. Примером равномерной коррозии может служить коррозия при взаимодействии меди с азотной кислотой,
454
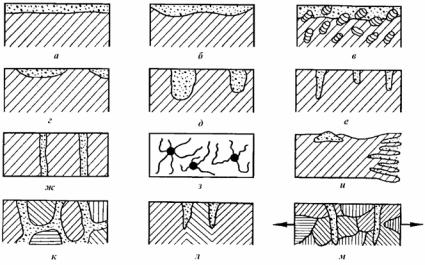
алюминия – с растворами щелочей, коррозия стальных труб на открытом воздухе. Неравномерную коррозию можно наблюдать, например, при коррозионном разрушении углеродистой стали в морской воде. Сплошная коррозия является наименее опасным видом коррозии материала, прочностные свойства которого изменяются незначительно.
Рис. 7.3. Типичные коррозионные разрушения:
а– равномерное; б – неравномерное; в – избирательное; г – пятнами;
д– язвами; е – точечное; ж – сквозное; з – нитевидное;
и– подповерхностное; к – межкристаллитное; л – ножевидное;
м– коррозионное растрескивание
При местной (локальной) коррозии на поверхности металла обнаруживаются участки различной степени разрушения, вызванные неоднородностью металлической фазы и различным составом коррозионной среды. Наиболее характерными видами местной коррозии являются коррозия в виде пятен – поражений заметно углубленных в поверхность металла (рис. 7.3,г); язв – поражений, сильно углубленных в толщу металла (рис. 7.3,д); точек (питтингов), глубоко проникающих в металл (рис. 7.3,е,ж) и перерастающих в сквозное проникновение.
455
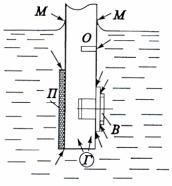
Есть понятие подповерхностная коррозия, когда металл разрушается под частично поврежденными защитными покрытиями (пленки, лаки и т.п.); продукты коррозии сосредоточиваются внутри металла, вызывая вспучивание и расслоение металла (рис. 7.3,и). Для сварных швов при работе в жидких средах с высокой коррозионной активностью характерна ножевая коррозия, локализованная в виде специфичных ножевидных надрезов (рис. 7.3,л). Разрушение металла под прокладками, в зазорах (щелях) между двумя металлами, при неплотном контакте металла с коррозионно-инертным материалом (рис. 7.4), в резьбовых и клепаных соединениях, в твэле между оболочкой и сердечником имеет место щелевая коррозия. Контактная коррозия – это электрохимическая коррозия, вызванная контактом металлов с разными электродными потенциалами в данном электролите (например, коррозия стальных водопроводных труб, соединенных с латунными кранами).
Рис. 7.4. Благоприятные места для развития щелевой коррозии (показаны стрелками):
П – изолирующее покрытие; Г – газовый пузырёк; О – узкое
отверстие; В – резьбовое соединение с шайбами, фланцами, прокладками; М – граница соприкосновения раствора с металлическим изделием
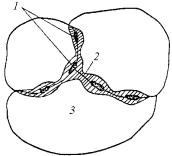
Одним из наиболее опасных видов местной коррозии является связанная со структурной неоднородностью межкристаллитная коррозия (МКК), которая, не разрушая зерен металла (катод), продвигается вглубь по их менее стойким границам (анод, см. рис. 7.3,к). На рис. 7.5 показана межкристаллитная коррозия на сварном шве коррозионно-стойкой стали с 18 % Cr и 8 % Ni, вызываемая выпадением карбида хрома. Окружающие зоны при этом обедняются хромом и становятся анодными по отношению к основному материалу.
456
Местная коррозия более опасна, чем сплошная, так как может либо значительно снизить прочностные свойства стенок аппарата (резервуара, трубопровода) или оболочки твэла, либо привести к сквозным поражениям и нарушению герметичности.
Рис. 7.5. Межкристаллитная коррозия на сварном шве:
1 – выделения карбида хрома;
2 – зона, обеднённая хромом (анод);
3 – зерно аустенитной хромоникелевой стали (катод)
Сплавы некоторых металлов подвержены избирательной коррозии, когда один из компонентов (или структурная составляющая) сплава разрушается, а остальные остаются практически без изменений (см. рис. 7.3,в). Так, при контакте латуни с раствором серной кислоты происходит компонентно-избирательная коррозия – процесс обесцинкования латуни, приводящий к обеднению сплава цинком и образованию на поверхности губчатого медного осадка. При этом может иметь место локальное (пробковидное) разрушение или равномерное коррозионное расслаивание поверхности (например, трубы), уменьшающее ее прочность и пластичность.
Структурно-избирательная коррозия происходит, например, при погружении стали или чугуна в раствор азотной кислоты, когда разрушается ферритная структура, а цементит остается без изменений, образуя пористый скелет, сохраняющий первоначальную форму изделия.
По характеру дополнительных воздействий, которым подверга-
ется металл одновременно с воздействием агрессивной среды, можно выделить такие виды коррозии, как коррозия под напряжением. Она характеризуется разрушением металлов (коррозионное растрескивание) в зоне действия знакопеременных или растягивающих нагрузок, остаточных деформаций или термических напряжений (рис. 7.3, м). Трещины могут быть межкристаллитными
457
