
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
или транскристаллитными в зависимости от величины остаточных внутренних или приложенных извне напряжений, характера агрессивной среды, структуры материала, длительности воздействия, температуры, степени пластической деформации, поведения защитных пленок на материале.
Почти все конструкционные металлические материалы в определенных условиях подвержены коррозионному растрескиванию под напряжением (КНР).
Одновременное воздействие циклических растягивающих напряжений и коррозионной среды вызывает коррозионную усталость – происходит понижение предела выносливости металла (валы гребных винтов, рессоры автомобилей и др.).
Разрушение металла при одновременном воздействии коррозионной среды и сил трения (например, в условиях воздействия на конструкции твердых абразивных частиц при потоке загрязненной механическими примесями воды, или при скольжении соприкасающихся поверхностей) называют коррозией при трении, или эрозионной коррозией. При колебательном перемещении соприкасающихся металлических поверхностей возникает фреттинг-коррозия. Сюда же относится и кавитационная коррозия – разрушение поверхности металла или сплава одновременным коррозионным и ударным воздействием агрессивной среды в результате образования и схлопывания пузырьков газа на динамической поверхности раздела металл–жидкость (коррозия лопастей гребных винтов). На поверхности образуется ряд питтингов или небольших, но глубоких трещин.
7.2.Химическая коррозия металлов
7.2.1.Химическая газовая коррозия
Под химической коррозией подразумевают взаимодействие металлической поверхности с окислительным компонентом окружающей среды по механизму химических гетерогенных реакций, т.е. когда атом металла с находящимися в его сфере валентными электронами взаимодействует непосредственно в точке контакта с
458
молекулой окислительного реагента, например кислорода. При этом в результате обмена электронами одновременно происходит переход металла в ионное состояние (окисление металла) Ме → Меz+ + ze–, где z – валентность металла, и восстановление окислительного компонента коррозионной среды О2 + ze– → →(z/2)O2–. Продуктом такого коррозионного процесса (суммарной реакцией) является химическое соединение металла с окислительным компонентом среды Ме + О2 → МеОz/2.
Химическая коррозия наблюдается при действии на металлы сухих газов (воздуха, продуктов сгорания топлива и др.) и жидких неэлектролитов (нефти, бензина и других органических жидкостей).
Наиболее распространенным и практически важным видом хи-
мической коррозии является газовая, т.е. коррозия металлов в газовой среде в отсутствии электропроводящих растворов. Газовая коррозия имеет место в технологических процессах, особенно в металлургических и химических производствах, при работе металлических конструкций, арматуры нагревательных печей, деталей двигателей внутреннего сгорания, газовых турбин, сопел космических аппаратов, при термической обработке, горячей деформации металлов и др.
Для большинства процессов основным условием осуществления химической газовой коррозии является отсутствие на поверхности металла пленки воды. Это может быть достигнуто при соблюдении одного из трех условий:
а) реагирующие газы содержат минимальное количество влаги (не более сотых долей процента);
б) контакт металла и газов осуществляется при высоких температурах, превышающих «точку росы», когда конденсации влаги на поверхности металла не происходит;
в) металл находится в среде неполярных органических соединений.
В технологических процессах часто вводят стадию осушки газов для снижения их коррозионной активности (например, для снижения коррозионной активности хлор осушают серной кислотой до содержания влаги 0,003–0,04 %).
459
Область существования высокотемпературной газовой коррозии определяется интервалом температур. Нижняя граница соответствует температуре конденсации пара на поверхности металла. Это состояние, называемое «точкой росы», зависит от парциального давления паров воды. Для воздуха при атмосферном давлении оно оценивается температурой, равной 240–250 °С, а для отходящих газов теплоэлектростанций 90–100 °С.
При температурах, превышающих «точку росы», начинается область химической газовой коррозии. Верхняя граница определяется таким свойством металла, как жаростойкость, т.е. способность металла сопротивляться коррозионному воздействию газов при высоких температурах.
7.2.2. Термодинамика химической газовой коррозии металлов
В природных условиях большинство металлов находится в связанном (ионном) состоянии в виде оксидов или солей. Это состояние для них является термодинамически наиболее устойчивым в отличие от промышленных условий, где они используются в металлическом состоянии как конструкционные материалы. Термодинамическая неустойчивость металлов в различных газовых или жидких неэлектропроводных средах при данных внешних условиях (температуре и давлении) является основной причиной химической коррозии металлов. Термодинамическую возможность протекания коррозионного процесса определяют по знаку и величине изменения потенциала Гиббса Gт химических реакций. Расчет Gт проводится по уравнению изотермы химической реакции с использованием справочных данных по термодинамическим свойствам веществ в стандартном состоянии.
Для наиболее распространенного процесса газовой коррозии металлов – реакции окисления металла кислородом
mMe(т) + (mz/4)O2(г) = MemOmz/2(т),
протекающей при р, Т = const, уравнение изотермы представлено в виде
Gт = RT 2,303 lg(1/pO2mz/4) – RT 2,303 lg(1/pO2mz/4)равн =
460
= RT 2,303 lg(1/pO2mz/4) – RT 2,303 lgKр =
= RT 2,303.lg(1/pO |
mz/4) + |
Go , |
(7.2) |
|
2 |
т |
|
где рО2 – парциальное давление кислорода, соответствующее исходному состоянию системы, атм; (рО2)равн – парциальное давление
кислорода, соответствующее равновесному состоянию системы (давление диссоциации оксида), атм; m – число атомов металла в молекуле оксида; z – валентность металла; Kр – константа химиче-
ского равновесия; Gтo = –RT 2,303 lgKр – изменение стандартного изобарно-изотермического потенциала ( Gт при рО2 = 1 атм),
кал/моль.
Термодинамическая возможность протекания реакции окисления металла характеризуется также давлением диссоциации, определяемого из реакции, противоположной (7.1). Эта меняющаяся с температурой критическая величина есть давление кислорода, соответствующее при данной температуре равновесию с оксидом и металлом: рО2 = (рО2)равн.
Из уравнения (7.2) следует, что самопроизвольное протекание реакции (7.1) возможно ( Gт < 0), если при данных условиях рО2>(рО2)равн. Если давление кислорода в данных условиях станет
ниже этой равновесной величины, т.е. рО2 < (рО2)равн, то оксид будет диссоциировать на металл и кислород, и окисление невозможно. Температурная зависимость равновесного давления диссоциации определяется из уравнения (7.2):
lg(рО2)равн = 4 Gтo /(2,303RTmz). |
(7.3) |
Рассмотренные соотношения используют для определения условиий по предотвращению газовой коррозии. Например в металлургии, снижая парциальное давление кислорода в газовой среде, предохраняют металл от окисления при высоких температурах.
Если металл образует несколько оксидов, например FeO, Fe2O3, и Fe3O4, то все они обладают различными давлениями диссоциации. Наиболее богатый кислородом оксид превращается в оксид с меньшим содержанием кислорода, а не в чистый металл.
В реальных системах в отличие от стандартных реагенты могут находиться при высоких или низких давлениях и температурах,
461
отличаться составом и состоянием материалов. Поэтому необходимо учитывать термодинамическую активность (см. п. 4.6.1) компонентов системы. Для газов активность компонента системы в обычных условиях можно считать равной его парциальному давле-
нию: аi = pi.
Для процесса окисления металла в воздушной атмосфере величину рО2 можно считать постоянной (при атмосферном давлении
рО2 ≈ 0,2 атм). Зная давление диссоциации оксида металла и парци-
альное давление кислорода в газовой смеси, можно определить температурные границы термодинамической вероятности данного процесса. Давление диссоциации оксида растет с повышением температуры. Скорость химической реакции окисления металла также растет с температурой. Таким образом, степень термодинамической возможности окисления металла с ростом температуры падает, а реальная скорость окисления возрастает.
Для золота давление атмосферного кислорода слишком мало для существования устойчивого оксида при комнатной температуре. Для реакции окисления серебра 4Ag + O2 = 2Ag2O при Т = = 300 К равновесное давление кислорода равно 8,4·10–5 атм, при Т = 400 К – 4,9·10–1 атм., а при Т = 500 К достигает 249 атм. Следовательно, при Т > 400 К серебро не может окисляться в результате непосредственного взаимодействия с кислородом. В случае
окисления железа по реакции 2Fe + O2 = 2FeO давление диссоциации мало. При Т = 600 К оно равно 5,1·10–42 атм, а при 2000 К
всего 1,6·10–7 атм, т.е. железо будет окисляться и при высокой температуре. Это же относится и к меди. Еще активнее в этом отношении алюминий, магний.
Поскольку большинство металлов образуют прочные оксиды, значения давлений диссоциации оксидов обычно очень малы. Их окисление возможно в газовой фазе, содержащей даже небольшие количества кислорода, и тем более в атмосфере воздуха.
Величина изменения стандартного потенциала Гиббса Gтo химической реакции (например, окисления металлов кислородом или другим окислителем), отнесенным к 1 г-экв. металла, т.е. Gтo /mz (где m – число атомов металла в молекуле оксида, z – валентность
462
металла), характеризует реакционную способность (химическое сродство) металлов к окислителю и термодинамическую устойчивость продуктов химической коррозии металлов. Более отрица-
тельные значения Gтo /mz указывают на более высокую реакцион-
ную способность (химическое сродство) металла и более высокую термодинамическую устойчивость продукта химической коррозии. Химическое сродство зависит не только от природы реагирующих веществ и температуры, но и от их парциальных давлений. Вели-
чину Gтo , характеризующую сродство металла к кислороду, можно определить из выражения
Gтo = –2,303RT lgKр, |
(7.4) |
входящего в уравнение (7.2), или из значения давления диссоциации оксида рМеО = (рО2)равн при температуре Т по уравнению
Gтo = 2,303RT mzlg(рО2)равн/4, |
(7.5) |
вытекающему из зависимости (7.3).
В табл. 7.2 приведены данные по изменению энергии Гиббса для реакций перехода некоторых металлов в ионное состояние при взаимодействии их с кислородом.
Таблица 7.2
Изменение свободной энергии ( G°) для реакций окисления металлов при стандартных условиях (25 °С; 0,1 МПа)
Реакция |
G°обр, |
Реакция |
G°обр, |
|
кДж/г-экв. |
кДж/г-экв. |
|||
|
|
|||
К = К+ + e– |
–360,9 |
Co = Co2+ + 2e– |
–105,5 |
|
Ca = Ca2+ + 2e– |
–356,3 |
Ni = Ni2+ + 2e– |
–102,6 |
|
Na = Na+ + e– |
–340,3 |
Sn = Sn2+ + 2e– |
–91,8 |
|
Mg = Mg2+ + 2e– |
–307,3 |
Pb = Pb2+ + 2e– |
–90,9 |
|
Al = Al3+ + 3e– |
–239,5 |
Cu = Cu2+ + 2e– |
–46,14 |
|
Mn = Mn2+ + 2e– |
–192,2 |
Ag = Ag+ + e– |
–8,51 |
|
Zn = Zn2+ + 2e– |
–153,6 |
Pd = Pd2+ + 2e– |
+16,54 |
|
Cr = Cr3+ + 3e– |
–150,3 |
Ir = Ir3+ + 3e– |
+17,84 |
|
Fe = Fe2+ + 2e– |
–127,3 |
Pt = Pt2+ + 2e– |
+36,0 |
|
Cd = Cd2+ + 2e– |
–117,2 |
Au = Au3 + 3e– |
+65,73 |
|
|
|
463 |
|

В начале таблицы расположены металлы с наиболее высоким сродством к кислороду (наименьшее значение величины G°): K, Ca, Na, Mg и другие, встречающиеся в природе в виде руд и солей (в окисленном состоянии). В конце таблицы находятся наиболее коррозионно-устойчивые металлы (Pd, Ir, Pt, Au), встречающиеся в природе в самородном состоянии.
На рис. 7.6 приведены температурные зависимости изменения энергии Гиббса для важнейших реакций окисления. Из него видно, что для большинства металлов с повышением температуры термодинамическая вероятность процесса окисления снижается.
Рис. 7.6. Зависимость G° образования некоторых оксидов от температуры
464
7.2.3.Пленки на металлах как продукты химической газовой коррозии
Врезультате химического взаимодействия металла с кислоро-
дом воздуха или другими окислителями (Cl, J, CO2, SO2 и др.) на его поверхности образуются пленки оксидов или других соединений, которые могут защищать металл от дальнейшего окисления. Процесс окисления (на примере образования оксидной пленки) твердого металла проходит через ряд последовательных стадий:
•адсорбция молекулярного кислорода на чистой поверхности металла;
•диссоциация молекул кислорода на атомы и их хемосорбция;
•возникновение зародышей оксидов на локальных участках поверхности;
•формирование и рост пленки оксида.
Для изучения процесса окисления необходимо наличие свежеприготовленной металлической поверхности. Такая поверхность, сформированная в условиях высокого вакуума или полученная быстрым изломом, имеет нерегулярную структуру (атомно-шеро- ховатая поверхность) из-за наличия поверхностных дефектов и чужеродных атомов (примесей).
Адсорбция кислорода на чистой металлической поверхности
возможна в виде молекул, атомов и ионов: О2, O−2 , O22− , О2–, О–, О.
Молекулярная форма адсорбции (О2) при положительных температурах обнаруживается только на металлах, оксиды которых в этих условиях нестабильны (Ag, Hg, Pt, Au). Молекулы кислорода адсорбируются на поверхности металла обратимо. Критерием обратимости является возможность увеличивать или уменьшать степень заполнения поверхности металла адсобированным кислородом посредством изменения парциального давления его в газовой фазе.
На большинстве технических металлов адсорбция кислорода протекает необратимо с образованием прочных химических соединений. Молекулы адсорбата (кислорода) адсорбируются, прежде всего, в местах с высоким адсорбционным потенциалом, обладающим значительными силами притяжения (границы зерен, точки
465
выхода краевых и винтовых дислокаций, вакансии, междоузлия и др.). Адсорбированные молекулы кислорода по мере заполнения площади поверхности и изменении ее температуры могут диссоциировать на атомы и взаимодействовать с молекулами или атомами адсорбента (металла). В зависимости от характера взаимодействия молекул адсорбента и адсорбата различают адсорбцию физиче-
скую и химическую (хемосорбцию). Физическая адсорбция наблю-
дается при низких температурах, близких к температуре конденсации адсорбата, и является результатом проявления дисперсионных сил и сил электростатического характера, аналогичных ван-дер- ваальсовым силам в реальных газах.
Увеличение концентрации адсорбированных молекул на поверхности уменьшает ее свободную энергию. В процессе адсорбции молекулы или атомы газа обычно утрачивают некоторую степень свободы, что приводит к уменьшению энтропии. Одновременное уменьшение свободной энергии и энтропии предполагает также уменьшение энтальпии ( H = G + T S), так что адсорбция обычно представляет собой экзотермический процесс. Количество выделяющейся при этом энергии зависит от геометрического положения участка, на котором происходит присоединение адсорбированного атома, а также от типа связи в кристалле.
Дисперсионные силы притяжения проявляются при адсорбции в местах поверхности, где молекула адсорбата (кислорода) близка к наибольшему числу молекул адсорбента (металла). Такими местами могут быть ямки (или дырки), ступени, изломы ступеней (уступы), вакансии и др. В ионных кристаллах энергия присоединения больше на выступах, вершинах и ребрах, так как эти места наиболее благоприятны для электростатического взаимодействия между полярными частицами или ионами противоположного заряда. Силы отталкивания в этом случае по сравнению, например, с гладкой (атомно-гладкой) поверхностью минимальны. Для кристаллов с ковалентной связью наблюдается обратное соотношение: энергия присоединения минимальна на выступах, вершинах и ребрах кристалла, так как в этих местах минимально число возможных ковалентных связей.
466
Физическая адсорбция протекает без заметной энергии активации и почти мгновенно, как только молекулы газа соударяются с поверхностью. Она не сопровождается химическим изменением молекул и может привести не только к образованию мономолекулярного слоя, но и к многослойному осадку частиц, а также к их миграции по поверхности. Теплота физической адсорбции, характеризующая прочность связи адсорбированных частиц с поверхностью металла, составляет 8–25 кДж/моль. В большинстве случаев поверхность твердого металла энергетически неоднородна. Она представляет собой серию элементарных площадок, обладающих различной теплотой адсорбции. Поэтому по мере заполнения однородной поверхности теплота адсорбции уменьшается.
При повышении температуры физическая адсорбция может переходить в хемосорбцию, если тепловая энергия превышает энергию активации такого процесса. Хемосорбция – результат химического взаимодействия адсорбированных атомов с атомами поверхностного слоя металла. При этом происходит переход электронов от металла к окислителю, что приводит к ионизации частиц и образованию между ними ионной или ковалентной связи. Теплоты хемосорбции значительно больше, чем при физической адсорбции, и изменяются в широких пределах от 80 кДж/моль для серебра до 800 кДж/моль для вольфрама. Хемосорбция зависит от кристаллографической ориентации дефектов на поверхности металла, а также от чистоты поверхности и химического сродства адсорбированного вещества (окислителя) к адсорбенту (металлу) и его электронам. Она проходит лишь до тех пор, пока на поверхности не образуется мономолекулярный слой адсорбата (кислорода).
На поверхности адсорбента поверх хемосорбированного монослоя окислителя, особенно при низких температурах, может образоваться несколько слоев окислителя, удерживаемых ван-дер- ваальсовыми силами. Эти слои распределяются по участкам поверхности неравномерно, образуя многослойные участки, закрытые монослоем или совсем свободные от адсорбата (рис. 7.7). Общий процесс перестройки приповерхностного слоя и образования оксида на начальных стадиях взаимодействия металла с кислородом можно представить следующим образом.
467

Рис. 7.7. Схема заполнения поверхности атомами при многослойной адсорбции
На начальных стадиях взаимодействия происходит захватывание электрона у металла молекулой кислорода и переход ее в молекулярный ион О2– с соответствующим образованием положительного иона металла на поверхности. Между обоими ионами возникает химическая связь. Подобный процесс происходит и с атомами кислорода, появившимися после диссоциации адсорбированных молекул (рис. 7.8). В результате переориентировки заряженных частиц происходит перераспределение зарядов и масс на поверхности металла, что ведет к появлению смешанного слоя, состоящего из симметрично расположенных ионов кислорода и металла, отражающих симметрию металлической подложки и ее кристаллографическую ориентацию.
Рис. 7.8. Сосуществование хемосорбированных атомов кислорода с физически адсорбированными на них молекулами О2 при низкой температуре:
1 – молекулы О2; 2 – хемосорбированные атомы кислорода; 3 – поверхностные атомы металла
Образовавшийся поверхностный смешанный слой способствует адсорбции новых молекул кислорода и новому перераспределению зарядов и масс (движение наружу катионов, имеющих размеры меньше атомных, а атомов кислорода, имеющих размеры меньше анионных, – на освобождающиеся места с образованием анионов под поверхностью нижележащего слоя металла).
468
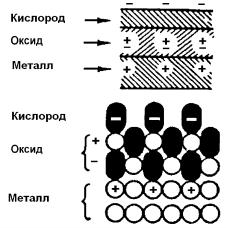
Таким образом, наличие первого кислородного слоя вызывает движение атомов и катионов металла наружу, возникновение второго кислородного слоя – дальнейшее движение металла и т.д. Внешняя часть кислородного слоя адсорбирована обратимо, а внутренняя, обогащенная катионами металла, подвержена химическому взаимодействию. Внешняя часть слоя заряжена отрицательно, а пограничный с металлом слой – положительно (рис. 7.9).
В смешанном слое взаимное расположение атомов и ионов металла и кислорода становится таким, что образуется двумерная кристаллическая решетка продукта химического взаимодействия. Для каждого типа кристаллической плоскости наблюдается наиболее вероятная конфигурация адсорбционного слоя, соответствующая требованиям геометрической природы и количеству связей, реализуемых между металлом и окислителем. Переход от хемосорбированного слоя кислорода к оксиду происходит быстрее, если существует кристаллохимическое соответствие между решетками металла и оксида, и расстояния между ионами металла в оксиде и в решетке металла близки. Переход хемосорбированного слоя кислорода в кристаллический оксид объясняется влиянием второго внешнего монослоя на изменение результирующей энергии Гиббса, вследствие чего двумерная структура оксида становится более устойчивой, чем монослой.
Рис. 7.9. Схема формирования оксидной пленки
на начальных стадиях взаимодействия металла с адсорбированным кислородом
469

Итак, при химическом взаимодействии окислительный компонент среды, отнимая у металла валентные электроны, одновременно вступает с ним в химическое соединение – продукт коррозии, который образует на поверхности корродирующего металла пленку.
Дальнейшее формирование оксидной пленки идет через образование зародышей (рис. 7.10). Дислокации, поверхностные дефекты, примеси служат местами образования зародыша, где двумерная структура адсорбированного кислорода и металла переходит в трехмерную с правильным чередованием атомов металла и кислорода. После образования хаотично размещающихся зародышей оксида окисление идет путем роста отдельных кристаллитов до тех пор, пока поверхность полностью не покроется оксидным слоем.
Рис. 7.10. Схема образования и разрастания зародышей оксида на металле: а – первичная мелкокристаллическая пленка оксида; б – появление эпитаксических зародышей; в – рост зародышей вдоль поверхности металла; г – сплошная компактная плёнка оксида
Кристаллиты отличаются друг от друга как по скорости, так и по фазам роста. Вследствие этого, а также из-за тангенциальных усилий, границы образующихся кристаллитов не будут кристаллохимически согласованы между собой (рис. 7.11).
Рис. 7.11. Схематическое изображение роста оксидной плёнки на поликристалле
В решетке оксида возникает большое число дефектных мест, что создает возможность дальнейшей диффузии компонентов, а следовательно, выхода частиц металла в поверхностный слой с последующей адсорбцией кислорода. По мере образования поверхно-
470
