
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
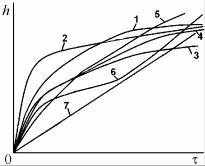
ческая h = k1lgt, обратная логарифмическая 1/h = k2 – k3lgt и асимптотическая h = k4(1 – exp(–k5t)), в которых k1 – k5 – константы, зависящие от коэффициента диффузии, давления кислорода и температуры.
Рис. 7.15. Типичные кривые законов роста плёнок на металлах:
1 – логарифмического;
2 – обратнологарифмического;
3 – кубического;
4 – параболического;
5 – сложнопараболического;
6 – паралинейного;
7 – линейного
Более толстые пленки, называемые окалинами, обычно появляются при высоких температурах и растут в соответствии с зависимостями: параболической h2 = k6t, линейной h = k7t, степенной hn = = k8t, где n > 2, а k6, k7, k8 – константы скорости реакций окисления. Иногда могут быть и промежуточные зависимости, например паралинейная (параболическая, переходящая в линейную), (рис. 7.15).
7.2.7. Механизм химической газовой коррозии
Ионно-электронная теория окисления Вагнера для толстых защитных пленок. Все теоретические работы в области низкотемпературного окисления основаны на развитии идей Вагнера о механизме высокотемпературного окисления металлов. В соответствии с ионно-электронной теорией Вагнера процесс роста пленки можно представить как результат работы своеобразного гальванического элемента, у которого поверхность металла на границе с пленкой является анодом (поставляет катионы и электроны), а поверхность пленки на границе с окислителем – катодом, на котором атомы кислорода принимают электроны. Оксидная пленка, имея смешанную ионно-электронную проводимость, работает одновременно как внутренняя и внешняя цепь замкнутой ячейки.
481
Кристаллическая решетка оксидов с ионной связью вследствие теплового движения ионов обычно имеет неоднородности в микрообъемах вещества, т.е. дефекты в виде вакантных узлов и ионов в межузлиях. Такие оксиды в зависимости от внешних физикохимических факторов и от способа получения соединения (температуры процесса, скорости нагрева и охлаждения и других условий) могут иметь избыток или недостаток взаимодействующих элементов по сравнению со стехиометрической формулой и обладать как ионной, так и электронной проводимостью. Обычно их относят к классу полупроводников.
Оксиды металлов, как и многие кристаллические неорганические соединения, имеют более или менее широкую область гомогенности, т.е. могут значительно отличаться по составу от стехиометрического соотношения компонентов. Области гомогенности могут лежать по обе стороны от стехиометрического состава (двусторонние фазы переменного состава) или находиться с одной стороны от стехиометрического состава (односторонние фазы переменного состава). Примером двусторонней фазы является закись титана, состав которой может изменяться в пределах от TiO0,6 до TiO1,3. К односторонним фазам переменного состава относятся, например, оксиды Nb2O5–δ и TiO2–δ, характеризующиеся дефицитом кислорода (анионов), и оксид железа Fe1–δO, у которого наблюдается недостаток металла (катионов).
Рост толщины образовавшейся оксидной пленки, или скорость химической газовой коррозии, определяется скоростью диффузии металла и окислителя, прямо пропорциональной концентрации дефектов, по которым перемещаются ионы металла и кислорода. Чем большее отклонение от стехиометрического состава обнаруживает данное соединение, образующее окалину, тем хуже защитные свойства этой окалины. Так, вюстит, составляющий основную часть оксидной пленки на железе при высоких температурах, обнаруживает сильное отклонение от стехиометрического состава: Fe0,88O составляет 0,12 молей атомов железа на моль FeO. Ускорение процесса коррозии этого металла при высоких температурах можно объяснить значительной концентрацией катионных вакансий в кристаллической решетке вюститной фазы, что способствует
482
быстрой диффузии катионов железа в направлении к внешней поверхности окалины.
Оксид никеля имеет во много раз меньшее отклонение от стехиометрического состава (Ni0,9999O), в связи с чем скорость окисления этого металла значительно ниже, чем железа при тех же условиях. Сульфиды металлов, как правило, отличаются большим отклонением от стехиометрического состава, чем оксиды, с чем связана большая скорость серной коррозии в сравнении с оксидной.
Необходимо заметить, что, кроме концентрации дефектов (Cd) в окалине, решающим фактором в отношении массопереноса является подвижность этих дефектов (Dd), так как коэффициенты диффузии – произведения этих двух величин D = Cd·Dd.
Немаловажную роль в процессе окисления играет и взаимодействие дефектов решетки между собой, вызывающее образование дефектных комплексов, кластеров и сверхструктур. Эти явления вызывают существенные изменения в форме структуры дефектов, особенно в случаях соединений с большой концентрацией дефектов решетки, как, например, Fe1–δO, WO3–δ, TiO2–δ, что существенно снижает скорость диффузии ионов металла и окислителя.
Диффузионный массоперенос или направленное перемещение ионов в окалине осуществляется по одному из двух возможных механизмов: 1) межузельному и 2) вакансионному (см. п. 3.4.2).
Первый механизм реализуется при образовании оксидов, ионы металлов которых имеют небольшие размеры по сравнению с па-
раметрами решетки (ZnO, CdO, BeO, Al2O3, Fe2O3, TiO2, ZrO2, Nb2O5, MoO3 и др.). Эти оксиды имеют избыток ионов металла по сравнению со стехиометрическим составом и относятся к полупроводникам n-типа. Они увеличивают свою электропроводность при нагреве в восстановительной атмосфере.
Второй механизм более вероятен в том случае, когда возможно образование оксидов с пустыми узлами в кристаллической решетке (Cu2O, FeO, NiO, WO2, Cr2O3 и др.). Эти оксиды имеют избыток ионов кислорода по сравнению со стехиометрическим составом и относятся к полупроводникам p-типа. Они увеличивают свою электропроводность при нагреве в окислительной атмосфере.
483
Диффузия катионов в защитной пленке для соблюдения электронейтральности сопровождается одновременным перемещением в том же направлении эквивалентного числа электронов в междоузлиях при первом механизме и по «электронным дыркам» (катионам с более высокой валентностью) при втором механизме.
Низшие оксиды тугоплавких переходных металлов (TiO, VO и др.), относящиеся к соединениям, имеющим двусторонние фазы переменного состава, относят к полупроводникам амфотерного типа.
Из-за ограниченной возможности перемещения ионов в кристаллической решетке ионная проводимость в оксидах невелика, а электронная проводимость обычно намного превосходит ионную и растет при увеличении температуры.
Так как контролирующим фактором скорости газовой коррозии является диффузия реагирующих частиц через кристаллическую решетку оксида, считается, что реакция на границах фаз протекает быстро и устанавливается термодинамическое равновесие между оксидом и газообразным кислородом на поверхности раздела ок- сид–кислород и между металлом и оксидом на фазовой границе между ними.
Движущей силой реакции является уменьшение свободной энергии при образовании оксида. В оксидной пленке возникают градиенты концентрации компонентов. На границе раздела оксид– газ (MeO/O2) парциальное давление кислорода равно давлению кислорода в газовой фазе рО2(г), а на границе металл–оксид (Me/MeO)
оно равно равновесному давлению диссоциации оксида (упругости диссоциации) в контакте с металлом рО2(д). На границе Ме/МеО
концентрация катионов максимальна и они диффундируют через слой оксида к границе МеО/О2, где реагируют с кислородом (О2–). Так как рО2(г) > рО2(д), то на границе МеО/О2 непрерывно образуются
катионные вакансии. На границе Ме/МеО концентрация анионов О2– мала и при образовании оксида в нем образуются анионные вакансии.
Итак, концентрация О2– и катионных вакансий максимальна на границе МеО/О2 и минимальна на границе Ме/МеО. Концентрация катионов и анионных вакансий максимальна на границе Ме/МеО и минимальна на границе МеО/О2.
484
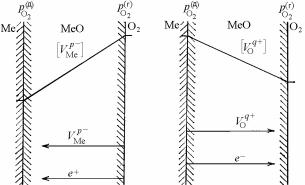
Вследствие градиента концентрации от границы Ме/МеО к границе МеО/О2 идет диффузия катионов и анионных вакансий, а от границы МеО/О2 к Ме/МеО – анионов (О2–) и катионных вакансий. Электроны за счет туннельного эффекта мигрируют от границы Ме/МеО к границе МеО/О2 (рис. 7.16). Отсюда следует, что рост толщины оксидной пленки обязан направленному перемещению через оксид не нейтральных атомов, а эквивалентных количеств положительных и отрицательных носителей тока – катионов, анионов, электронов и вакансий.
Перенос заряженных частиц происходит под действием, с одной стороны, градиента концентрации компонентов (химического потенциала), возникающего из-за изменения состава оксида по мере удаления от границы раздела «металл–оксид» и приближения к границе раздела «оксид–газ»; с другой стороны, под влиянием градиента электрического потенциала, возникающего из-за различной концентрации зарядов на границах раздела. Подвижности и коэффициенты диффузии катионов, анионов, их вакансий и электронов не одинаковы. Это приводит к разделению зарядов в растущей оксидной пленке. Результирующий пространственный заряд создает в оксидной пленке электрическое поле, противодействующее дальнейшему разделению зарядов. Этим достигается стационарное состояние, при котором через окалину никакой результирующий электрический ток не течет.
а б
Рис. 7.16. Схемы градиентов концентраций вакансий ионов металла (а) и кислорода (б) и процессов переноса в оксидных плёнках
485
Итак, скорость химической газовой коррозии, а, следовательно, и рост толщины пленки, объясняется диффузией компонентов, обусловленной химическим потенциалом, и миграцией ионов и электронов, обусловленной электрическим потенциалом, т.е. ионной и электронной проводимостью оксида.
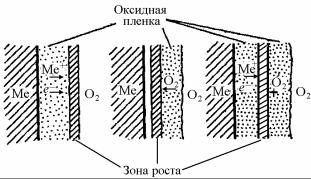
При достаточно толстых слоях оксида (> 1 мкм) градиент электрического потенциала невелик, и перенос вещества обязан только градиенту концентрации (химическому потенциалу). В этом случае рост толщины слоя идет, согласно теории Вагнера, по параболическому закону. Скорость перемещения ионов металла и кислорода навстречу друг другу определяет местоположение зоны роста оксидной пленки.
Если сквозь пленку диффундирует, в основном, кислород, то зоной роста пленки будет граница между пленкой и металлом (рис. 7.17, б).
Рис. 7.17. Схемы расположения зоны роста плёнки при окислении металла по Вагнеру:
а – зона роста на внешней поверхности плёнки; б – зона роста на границе между плёнкой и металлом; в – зона роста внутри плёнки
Так как радиусы ионов металла (катионов) меньше радиуса ионов кислорода О2– (анионов) (см. табл. 7.6), то они более подвижны при диффузии или миграции, что обеспечивает преимущественный рост пленки на внешней поверхности или вблизи внешней границы (рис. 7.17,а). Во многих случаях скорости встречного
486

движения частиц соизмеримы, и тогда зона роста находится внутри пленки (рис. 7.17,в).
|
|
|
|
|
Таблица 7.6 |
||
|
Атомные и ионные радиусы (по Паулингу) |
|
|
|
|||
|
|
|
|
|
Ионный |
|
|
Элемент |
Символ |
Атомный |
Ион |
|
|
||
Атома |
радиус, Å |
|
радиус, Å |
|
|
||
|
|
|
|
|
|||
Водород |
Н |
0,30 |
Н+ |
|
1,27 |
|
|
Алюминий |
Al |
1,43 |
Al3+ |
|
0,50 |
|
|
Магний |
Mg |
1,62 |
Mg2+ |
|
0,65 |
|
|
Калий |
К |
2,23 |
К+ |
|
1,33 |
|
|
Кальций |
Са |
1,97 |
Ca2+ |
|
0,99 |
|
|
Титан |
Ti |
1,49 |
Ti3+ |
|
0,69 |
|
|
Хром |
Cr |
1,25 |
Cr3+ |
|
0,65 |
|
|
|
|
|
Cr6+ |
|
0,52 |
|
|
Железо |
Fe |
1,26 |
Fe2+ |
|
0,75 |
|
|
|
|
|
Fe3+ |
|
0,67 |
|
|
Кобальт |
Со |
1,25 |
Со2+ |
|
0,82 |
|
|
|
|
|
|
|
0,78 |
|
|
Никель |
Ni |
1,25 |
Ni2+ |
|
|
|
|
|
|
|
|
|
0,96 |
|
|
Медь |
Cu |
1,28 |
Cu+ |
|
|
|
|
|
|
|
|
|
0,74 |
|
|
Цинк |
Zn |
1,31 |
Zn2+ |
|
|
|
|
|
|
|
|
|
0,62 |
|
|
Молибден |
Mo |
1,39 |
Mo6+ |
|
|
|
|
|
|
|
|
|
1,26 |
|
|
Серебро |
Ag |
1,44 |
Ag+ |
|
|
|
|
|
|
|
|
|
1,21 |
|
|
Свинец |
Pb |
1,74 |
Pb2+ |
|
|
|
|
|
|
|
|
|
1,40 |
|
|
Кислород |
О |
0,6 |
О2– |
|
|
|
|
|
|
|
|
|
1,84 |
|
|
Сера |
S |
1,04 |
S2– |
|
|
|
|
|
|
|
|
|
1,81 |
|
|
Хлор |
Cl |
1,07 |
Cl– |
|
|
|
|
Встречная диффузия ионов металла и кислорода протекает в электрическом поле, поэтому уравнения кинетики и ее основные константы могут быть выведены, исходя из электрических параметров и закономерностей: величин ионной и электронной проводимости, чисел переноса ионов и электронов, закона Ома.
Константа скорости окисления тем больше при прочих равных условиях, чем больше изменение свободной энергии при образовании оксида и чем выше удельная электропроводность материала пленки. Если оксид обладает электроизолирующими свойствами,
487
дальнейшее окисление не происходит. Этим объясняется, например, стойкость алюминия к процессам окисления.
При окислении металлов переменной валентности (Fe, Co и др.)
вусловиях, допускающих образование нескольких различных оксидов, пленки могут иметь многослойную структуру. При этом оксид с максимальным содержанием кислорода обычно располагается во внешнем слое пленки (ближе к окисляющей газовой фазе), а соединение с минимальным содержанием кислорода прилегает к металлической основе. Рост толщины слоев происходит вследствие диффузии металла или окислителя, или их обоих, движущей силой которой является градиент концентрации, созданный разностью химических потенциалов. Образующийся наивысший оксид обычно является проводником n-типа, а наинизший – проводником p- типа. Если диффузия компонентов осуществляется по вакансионному механизму, то катионы диффундируют во внутреннем, а анионы – в наружном слое по направлению к поверхности раздела между двумя слоями, где происходит во многих случаях образование нового оксида.
Теория формирования тонких пленок (теория Кабреры и Мотта). Существует ряд теорий, объясняющих законы роста пленки при низких температурах на основании контроля процесса окисления переносом ионов или электронов в тонких пленках по механизмам, отличающимся от диффузионного. Эти теории базируются на различных моделях и постулатах, оправдываемых в ряде случаев
втех или иных пределах толщин пленок. На кинетические закономерности их роста сильное влияние оказывают: тип проводимости, вид зависимости скорости перемещения ионов или вакансий от напряженности поля, характер лимитирующей стадии процесса (например, образование катионных вакансий на границе оксидкислород или их исчезновения на границе оксид–металл и т.д.). Этим объясняется отсутствие единой непротиворечивой теории роста тонких пленок.
По одной из этих теорий, предложенной Кабрерой и Моттом, оксидный слой возникает при таких низких температурах, что диффузия ионов через пленку затруднена. В этом случае электроны металла могут проходить через тонкий еще слой оксида (< 2 нм)
488
