
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
и выходе из нее. Гелий очень текуч и требует высокой герметизации системы. Стоимость гелия очень высока.
Загрязнение гелия кислородом, углекислым газом, парами воды, углеводородными соединениями приводит к коррозии конструкционных материалов. Для предотвращения интенсивной коррозии массовая доля примесей в гелии не должна превышать 0,01 %. Но даже в этом случае наблюдается взаимодействие теплоносителя с коррозионно-стойкими сталями и никелевыми сплавами. Особенно чувствительны к содержанию примесей в гелии Zr, Ti, V, Mo, W, растворяющие примеси внедрения. Стали обладают достаточно хорошей коррозионной стойкостью в технически чистом гелии при температуре до 800–900 °С.
7.3.Электрохимическая коррозия
7.3.1.Основные признаки и причины
Электрохимическая коррозия – процесс самопроизвольного разрушения металлических материалов вследствие электрохимического взаимодействия их с окружающей электрически проводящей средой. При электрохимическом взаимодействии окислитель отнимает валентные электроны у металла и переводит его в ионное состояние, но при этом не вступает с ним в химическое соединение. Отличительным признаком электрохимической коррозии является протекание электрического тока по металлу (в виде электронов, освободившихся при ионизации атомов металла на аноде) и в электролите (в виде ионов).
Этот вид коррозии наиболее распространен. Он имеет место при взаимодействии металлов с жидкими электролитами (водой, водными и неводными растворами солей, кислот и щелочей, расплавленными солями и щелочами). Примерами электрохимической коррозии металлов являются: коррозия наружной обшивки судов в воде, металлических частей гидросооружений, трубопроводов в земле и атомных реакторах. В атмосферных условиях на поверхности любого металла образуется тонкая пленка влаги, в которой растворяются газы, оксиды, сульфиды и другие соединения, находящиеся в атмосфере, с образованием на металлической поверхности
506
соответствующих кислот и солей, являющихся составными частями электролитов.
Склонность металлических материалов к электрохимической коррозии, ее механизм и характер разрушения определяется силой связи электронов с атомами (потенциалом ионизации), а также свойствами электролитов, такими как концентрация, электропроводность, присутствие растворенных газов, степень диссоциации, коэффициент диффузии, числа переноса катионов и анионов и др.
7.3.2. Электролиты
Коррозионной средой при электрохимической коррозии являются вещества, обладающие ионной проводимостью и называемые электролитами. Их можно разделить на три группы:
1)твердые, представляющие собой кристаллические вещества, имеющие ионную проводимость;
2)расплавы солей (например, MgCl2, NaCl) – вещества, подвергающиеся электролитической диссоциации при плавлении;
3)растворы веществ, подвергающихся диссоциации при взаимодействии с растворителями (прежде всего водой).
Первая группа не является коррозионно опасной средой. Вторая обладает высокой коррозионной активностью, но при определенных температурных условиях. Наиболее распространенной и опасной средой являются электролиты третьей группы, основными из которых являются природные или искусственные водные растворы кислот, солей и щелочей.
Под влиянием электрического поля полярных молекул раство- рителя-сольвента (например, воды или спирта) происходит распад молекул электролита на отдельные положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. По способности к электролитической диссоциации электролиты делят на сильные (степень диссоциации α ≈ 1 для растворов солей и некоторых органических кислот) и слабые (α → 0 для растворов большинства органических кислот и оснований).
Ионы электролитов, появившиеся в растворе, притягиваются в зависимости от их знака к положительному или отрицательному
507
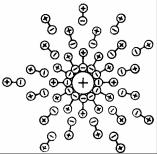
полюсу молекулы растворителя (воды). Вокруг ионов возникает оболочка из молекул воды (рис. 7.25).
Такие ионы называются гидратированными, а в неводных растворах – сольватированными. Энергия, выделяющаяся при таком процессе (гидратации или сольватации), называется энергией гидратации (сольватации).
Кроме гидратной оболочки каждый ион окружен несколькими ионами противоположного знака, образующих дополнительную оболочку, что замедляет их перемещение.
При растворении ионных соединений (солей, щелочей, кислот) в раствор переходят как анионы, так и катионы, при этом электрическая нейтральность электролита сохраняется. Число положительных и отрицательных зарядов ионов одинаково, но число ионов каждого знака может быть не одинаково. Например, молекула сер-
ной кислоты диссоциирует по реакции H2SO4 = 2H+ +SO24− на три
иона: два положительных однозарядных водорода и один двухзарядный ион кислотного остатка. Подобная картина наблюдается и при диссоциации хлорной меди:
CuCl2 = Cu2+ + 2Cl− .
Масса ионов в десятки и сотни тысяч раз больше массы электронов. Например, ион лития в 13000 раз тяжелее электрона. А после гидратации он становится еще более громоздким и менее подвижным.
7.3.3.Механизм электрохимической коррозии. Работа гальванического элемента
Простейшим примером электрохимической коррозии является работа гальванического элемента. Такой элемент состоит из двух электродов, соединенных ионным проводником – электролитом. Электродами называются проводники, имеющие электронную проводимость (проводники 1-го рода; чаще всего это металлы) и нахо-
508
дящиеся в контакте с ионным проводником (проводник 2-го рода). Элемент начинает работать (начинается электрохимическая коррозиия) при замыкании электродов. Электрическая энергия вырабатывается химическими реакциями, протекающими на электродах. На катоде идет химическое восстановление подошедших к нему отрицательных ионов электролита, а на аноде – окисление металла в положительные ионы, переходящих в раствор электролита. Элемент будет работать до тех пор, пока весь анод не окислится и растворится.
В электролите ток переносится как отрицательно, так и положительно заряженными ионами, движущимися в противоположных направлениях. Сила тока зависит от их подвижности и зарядов. Суммарный положительный и отрицательный ток в электролите элемента всегда равен суммарному току, переносимому электронами в металлическом проводнике во внешней цепи элемента. Закон Ома:
i = E / R , |
(7.21) |
(где i – сила тока; E – разность потенциалов; R – сопротивление) справедлив для токов, текущих как в металле, так и в электролите.
В гальваническом элементе катод считается положительным полюсом, анод – отрицательным. Катионами называются положительно заряженные ионы, в электролите они перемещаются по на-
правлению к катоду (например, H+ , Fe2+ ). Анионы всегда заряжены отрицательно ( Cl−, OH−, SO24− ) и движутся к аноду. Скорость дви-
жения ионов возрастает с повышением температуры электролита, с увеличением зарядности ионов при постоянстве массы. Наиболее быстро движется ион водорода; подвижность иона гидроксила в два раза меньше, а у остальных ионов подвижность еще в 3–4 раза меньше, чем иона гидроксила.
Работа, производимая гальваническим элементом при расходе 1 моль металла, определяется произведением количества электричества neF на ЭДС E:
A = neFE, |
(7.22) |
где ne – число молей электронов, протекающих через цепь; F – число Фарадея, равное 96493 Кл. Если элемент работает обратимо при
509
постоянном давлении и температуре, то произведенная им работа равна убыли свободной энергии − G = A :
G = −ne 96493 E |
(7.23) |
Если элемент работает необратимо (например,вырабатывает электроэнергию), то neFE < G, т.е. ЭДС меньше, чем при обратимом проведении реакции. Выражая E в вольтах, получаем величину
Gв джоулях.
7.3.4.Гетерогенность поверхности и микрогальванические элементы
Структурно-фазовое состояние поверхности любого металла (сплава) неоднородно и содержит те или иные включения и дефекты, которые образуют множество короткозамкнутых микроэлектродных элементов. При контакте с раствором электролита такие микрокоррозионные системы с катодными и анодными участками поверхности могут привести к разрушению (коррозии) всей поверхности металла. Причины, создающие гетерогенность (неоднородность) в системе металл–электролит разнообразны. Основными среди них можно назвать неоднородности металлической фазы, жидкой фазы и наложения внешних условий (рис. 7.26).
Неоднородность металлической фазы вызвана наличием электропроводящих макро- и микровключений (примесей, интерметаллических и других соединений, играющих роль микрокатодов), ликвации сплавов, наличием поверхностных дефектов (шероховатость, скопление дислокаций), анизотропностью металлического кристалла, неоднородностью и дефектами защитных оксидных пленок на поверхности металла. Атомы в зонах с несовершенной и искаженной структурой (границы зерен, участки в напряженном и деформированном состоянии) обладают избыточной свободной энергией и могут создавать анодные участки.
Неоднородность жидкой фазы (электролита) связана с различной концентрацией ионов на отдельных участках контакта фаз и концентрацией окислителей, различием pH отдельных зон объема электролита.
510
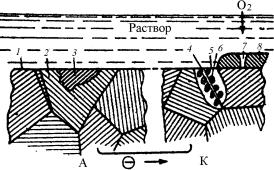
Рис. 7.26. Схематическое изображение многоэлектродной системы, включающей макро- и микроэлементы:
1 и 2 – различно ориентированные кристаллиты; 3 – шлаковое включение; 4 – граница между зёрнами; 5 – обеднённая легирующим компонентом зона твёрдого раствора; 6 – выделившееся из твёрдого раствора интерметаллическое соединение; 7 – пора в плёнке; 8 – защитная плёнка; А – менее аэрируемый участок (анод); К – более аэрируемый участок (катод)
Неоднородность наложения внешних физических условий вызывается различной температурой отдельных участков поверхности металла, различной интенсивностью облучения, неравномерным наложением внешнего электрического поля.
Основное отличие электрохимического механизма от чисто химического состоит в том, что взаимодействие окислителя с металлом при электрохимической коррозии разделяется на два самостоятельных, но сопряженных в общей цепи процесса; замедление одного из них тормозит другой.
1. Анодный процесс – переход атомов металла в раствор в виде гидратированных (или сольватированных) ионов с оставлением соответствующего числа электронов на поверхности металла:
ze− ← ze−Men+ + mH2O → Mez + mH2O. |
(7.24) |
Например, Zn → Zn2+ + 2e− .
Напомним, что процесс отдачи электронов атомами и ионами одних веществ атомам и ионам других называется окислением. Этот процесс происходит на анодных участках поверхности. Вещество, в состав молекулы которого входит элемент, присоединяющий электроны ( O2 ,Cl,SO2 ,OH и др.), называется окислителем.
511
2. Катодный процесс – присоединение электронов ионами или молекулами раствора (деполяризаторами), способными к восстановлению на катодных участках. Вещество, содержащее в составе своей молекулы элемент, отдающий электроны, называется вос-
становителем.
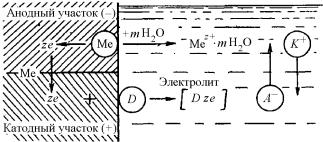
Принципиальная схема электрохимического коррозионного процесса приведена на рис. 7.27.
Рис. 7.27. Схема электрохимического коррозионного процесса
При электрохимической коррозии, как и при работе гальванического элемента, происходит окисление восстановителя (на анодных участках), восстановление окислителя (на катодных участках), движение ионов в растворе электролита и электронов в металле. Но в отличие от гальванического элемента в коррозионном элементе отсутствует внешняя цепь. Электроны при коррозии не выходят из корродирующего металла, а движутся внутри него. Химическая энергия реакции окисления металла не передается в виде работы, а лишь в виде теплоты.
Масса растворяющегося металла определяет количество освобождающихся электронов – силу тока многоэлектродной системы, называемой током коррозии. Как правило, представляет интерес удельная сила тока, приходящаяся на единицу поверхности корродирующего металла, т.е. плотность тока, определяющая общую скорость коррозии металла.
В соответствии с законами Фарадея, определяющими зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде (аноде или катоде), плотность тока может быть анодной или катодной.
512
Для реакции растворения металла величина потери массы металла в течение определенного времени позволяет рассчитать скорость его растворения, а из нее – плотность анодного тока ja:
ja = zF m / Sa AM t , |
(7.25) |
где АМ – атомная масса металла; ∆m – убыль этой массы металла за время t; Sa – площадь анода; z – число валентных электронов, F – число Фарадея.
7.3.5. Явления на границе раздела фаз металл–электролит
В узлах кристаллической решетки металлов находятся атомы, потерявшие один или несколько валентных электронов. Эти атомы называют ион-атомами. Пространство между узлами решетки заполнено электронным газом.
Отличие ион-атомов от нормальных атомов состоит в том, что они могут существовать только в связи с полусвободными электронами, в постоянном взаимодействии с ними. Если к ионам металла присоединяются электроны, то получаются нормальные атомы; если же от ион-атомов оторвутся электроны, то они превратятся в свободные ионы:
Me+ e− → Me+ + e− . |
(7.26) |
|
ион-атом |
ион электрон |
|
При контакте металла с электролитом (например, цинка с раствором серной кислоты) начинается сложное взаимодействие металла с компонентами раствора. Наиболее важным является взаимодействие поверхностных ион-атомов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности металла. В результате взаимодействия металл переходит в слабонасыщенный раствор в виде гидратированных ионов, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
Me+ e− + mH2O → Me+ mH2O + e− . |
(7.27) |
|
ион-атом |
гидратированный |
|
|
ион металла |
|
Электроны не могут устойчиво гидратироваться и в раствор не переходят. Появившиеся на растворяющихся (анодных) участках
513
поверхности избыточные электроны перетекают на различные включения и межкристаллитные нерастворяющиеся участки, служащие катодами. Это приводит к непрерывному смещению равновесия и дальнейшему растворению анодных участков. Металл становится заряженным отрицательно, а раствор – положительно. Если растворение металла происходит в растворе кислоты, то к катодным участкам, заряженным отрицательно (имеющим избыток электронов), притягиваются ионы водорода, которые здесь разряжаются (восстанавливаются) и выделяются в виде пузырьков газа:
2H+ + 2e− → 2H → H2 ↑ .
Если процесс растворения протекает в насыщенной кислородом воде, то коррозионный процесс можно представить схемой:
на аноде: 4Me+e− + 4H2O → 4Me+ 4H2O + 4e− , |
(7.28) |
|
на катоде: |
4e− + 2H2O + O2 → 4(OH)− . |
(7.29) |
В этом случае на анодных участках в раствор переходят ионы металла, а освобождающиеся электроны перетекают к катодным участкам и ионизируют кислород, образуя ионы гидроксила.
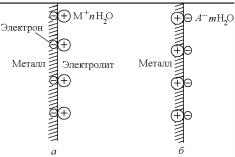
Рис. 7.28. Схема двойного электрического слоя:
а – при выходе иона металла из металла в раствор; б – при переходе катиона из раствора на поверхность металла
Перешедшие в раствор положительно заряженные ионы (катионы) металла начинают притягиваться к отрицательно заряженной поверхности металла, что затрудняет их свободное перемещение в объем раствора. На фазовой границе металл-раствор возникает
двойной электрический слой (д.э.с.) (рис. 7.28), который можно представить себе в виде плоского конденсатора, отрицательная обкладка которого – это поверхность металла, а положительная – соприкасающийся с ним слой растворенных катионов.
514
Возможен и другой вариант образования д.э.с., когда, например, при большой концентрации ионов ( Zn2+ ) в растворе ( ZnSO4 ) сна-
чала на отрицательно зарядившейся (как при растворении) поверхности металла будут разряжаться катионы из раствора (энергия связи в кристаллической решетке металла больше энергии гидратации). Катионы будут притягиваться и адсорбироваться (осаждаться) до тех пор, пока заряд на поверхности не достигнет такой величины, при которой дальнейшее осаждение прекратится из-за отталкивания одноименных зарядов металла и его ионов. В результате поверхность металла приобретает положительный заряд и также
образует д.э.с. с анионами ( SO24− ) из раствора. Электрическое поле,
возникающее между заряженными слоями, препятствует растворению металла (цинка) и может прекратить его совсем.
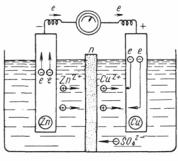
Если в контакте с раствором сернокислой меди находится медный электрод (как, например, в гальваническом элементе Якоби–
Даниэля, рис. 7.29), то ионы Cu2+ осаждаются на поверхности меди, а ионы SO24− остаются в слое раствора, прилегающем к метал-
лу. В этом случае положительная обкладка д.э.с. находится в металле, а отрицательная – в растворе.
Двойной электрический слой электрически нейтрален, внутри же слоя напряженность электрического поля может достигать больших значений. Благодаря значительным размерам заряженных поверхностей и малым расстояниям между ними д.э.с. обладает большой электроемкостью, которая может быть определена из зависимости, характерной для плоского конденсатора при
εd =1:
L = εd /(9 105 4 π dk ) = 8,85 10−8 / dk , |
(7.30) |
где L – емкость д.э.с., которая может достигать 20 мкФ/см2; εd – диэлектрическая постоянная среды; dk – расстояние от поверхности
515
металла до центра положительных зарядов в молекуле воды (расстояние между обкладками конденсатора).
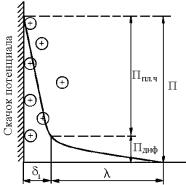
В обкладке «конденсатора», находящейся в растворе, различают два слоя: плотный слой ионов, отстоящий от поверхности на расстоянии, равном примерно их радиусу; разреженный (размытый), менее прочно связанный с поверхностью и где концентрация ионов падает, достигая концентрации, свойственной данному раствору в целом, и который называется диффузным слоем (рис. 7.30). Тол-
щина его в неразмешиваемых средах составляет δ =10−5 −5 10−4 м.
Рис. 7.30. Изменение потенциала металла в зависимости от распределения зарядов в растворе: Ппл. ч. – потенциал металла относительно раствора, приходящийся на плотную часть д.э.с. толщиной δ;
Пдиф.– потенциал металла, соответствующий диффузной части д.э.с. толщиной λ
В формировании двойного слоя кроме заряда ионов важен их радиус и поляризуемость. Эти свойства определяют взаимодействие ионов с поверхностью и окружающими их гидратными оболочками. Обычно сильнее притягиваются к поверхности ионы с большим числом внутренних электронов в электронной оболочке, т.е. тяжелые поливалентные катионы вследствие большей их поляризуемости.
Образование д.э.с. оказывает влияние на электрокинетические явления, среди которых можно назвать электрофорез – движение в жидкости взвешенных твердых частиц, пузырьков, капель другой жидкости под действием внешнего электрического поля; электроосмос – движение жидкости д.э.с. при наличии градиента потенциала в водной среде и др.
Как видим, в образовании д.э.с. могут принимать участие электроны, ионы и обладающие собственным дипольным моментом
516
